
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
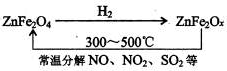
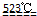 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑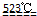 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市河西区高三总复习质量检测(二)理综化学试卷(解析版) 题型:填空题
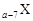 、
、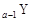 、
、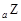 、
、 、
、 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
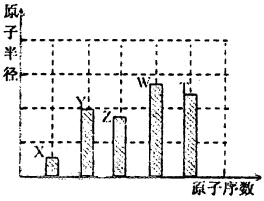
(l)W在周期表中的位置为_______________________。
(2)Y、Z的10电子氢化物分子中均含有的化学键类型为___________;其稳定性较强的是___________
(填化学式)。
(3)用化学方程式表示YZ2形成酸雨的反应:______________________。
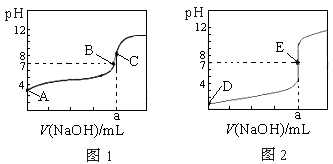
用精密pH试纸(精确到0.l)测定酸雨pH的操作是______________________。
(4)常温下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2气体,此反应的离子方程式为
______________________;此时溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W与X形成的气态化合物与足量Z2点燃完全反应(生成W的最高价
化合物),恢复至原状态,平均每转移l mol e_放热190 kJ,该反应的热化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略溶液体积的变化),测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)________HCl溶液中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH________(填“>7”、“<7”或“无法确定”)。
(3)常温下测得浓度为0.1mol·L-1的HA溶液的pH=3,则HA的电离常数Ka=
 (4)工业上用氯化铁溶液腐蚀铜制电路板。如下图,横坐标为溶液pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答下列问题
(4)工业上用氯化铁溶液腐蚀铜制电路板。如下图,横坐标为溶液pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答下列问题
①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol/L,
今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金
属阳离子为_____________。
②从图中数据计算可得Fe(OH)2的溶度积:
Ksp[Fe(OH)2]=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com