
我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如下: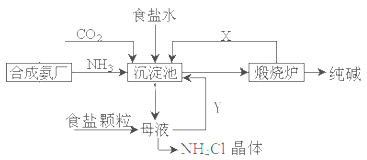
(1)完成有关反应的化学方程式
①沉淀池: NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是___________
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置模拟“联合制碱法”的第一步反应。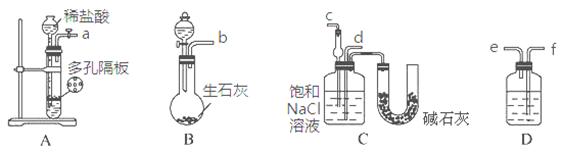
(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 。
为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含NaCl、NaHCO3杂质。
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加 试剂。
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32- +H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL。则纯碱样品中NaHCO3质量分数为 。
(1)2NaHCO3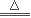 Na2CO3+CO2↑+H2O (3分)
Na2CO3+CO2↑+H2O (3分)
(2)C (2分) (3)D (3分)
(4)饱和NaHCO3溶液 (2分) (5)稀HNO3和AgNO3溶液(2分)
(6)84c(V2- V1)∕1000W (3分)
解析试题分析:(1)煅烧炉中主要是把沉淀池中得到的NaHCO3加热使之分解得到碳酸钠,方程式为2NaHCO3 Na2CO3+CO2↑+H2O;(2)联合制碱法的生产原料为:食盐、NH3、CO2,A正确;副产物氯化铵可做氮肥,正确;生产过程中可循环利用的物质除CO2外,还有NaCl,错误;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,正确。(3)“联合制碱法”的第一步反应为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,故模拟装置中接口连接顺序为b接c;a接f、e接d;(4)D装置的作用是除去CO2中混有的HCl,可选用饱和NaHCO3溶液;(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加稀HNO3和AgNO3溶液;(6)根据所给信息可知,样品中NaHCO3的物质的量为c(V2-V1)/1000 mol,故纯碱样品中NaHCO3质量分数为84c(V2- V1)∕1000W。
Na2CO3+CO2↑+H2O;(2)联合制碱法的生产原料为:食盐、NH3、CO2,A正确;副产物氯化铵可做氮肥,正确;生产过程中可循环利用的物质除CO2外,还有NaCl,错误;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,正确。(3)“联合制碱法”的第一步反应为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,故模拟装置中接口连接顺序为b接c;a接f、e接d;(4)D装置的作用是除去CO2中混有的HCl,可选用饱和NaHCO3溶液;(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加稀HNO3和AgNO3溶液;(6)根据所给信息可知,样品中NaHCO3的物质的量为c(V2-V1)/1000 mol,故纯碱样品中NaHCO3质量分数为84c(V2- V1)∕1000W。
考点:考查钠及其化合物的性质以及氯离子的检验。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:单选题
某同学通过系列实验探究Mg及其化合物的性质, 操作正确且能达到目的的是
操作正确且能达到目的的是
| A.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 |
| B.将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性 |
| C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A.、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)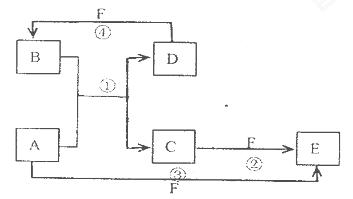
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电予数D是A的2倍,F的浓溶液与A D反应都有红棕色气体生成,则A为___________________,
反应④的化学方程式为____________________________________.
(2)若A为常见的金属单质,D F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________________.
(3)若A.D.F都是短周期非金属元素单质,且A.D所含元素同主族,A.F所含元素同周期,则反应①的化学方程式为________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2
①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:
①铜单质放置于潮湿空气中,容易生成碱式碳酸铜,反应化学方程式是 ;
②步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 ;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe2O3+3H2SO4 =Fe2(SO4)3+3H2O
ii) Cu2S+ Fe2(SO4)3 =CuSO4+CuS+2FeSO4
iii)
④步骤Ⅱ中调节pH后的溶液中,铜离子浓度最大不能超过 mol/L。
(已知Ksp[(Cu(OH)2)]=2×10-a)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(本题共13分)甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示: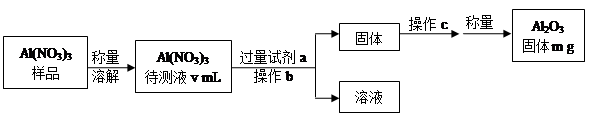
①加入试剂a后发生反应的离子方程式为 。
②操作b为 ,操作c为 。
③Al(NO3)3待测液中,c (Al3+) = mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示: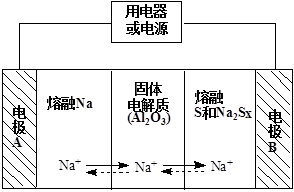
①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示: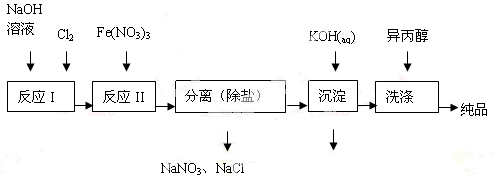
①洗涤粗品时选用异丙醇而不用水的理由是 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。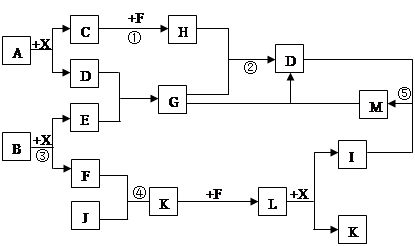
(1)写出化学式:A ,E ,L ;
(2)在反应①②③④⑤中属于氧化还原反应的是 ;
(3)反应③化学方程式为: ;
(4)写出下列离子方程式:反应② ;
G溶液与M溶液的反应 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com