

| 2.54×106 |
| 254 |


科目:高中化学 来源: 题型:
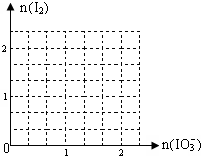
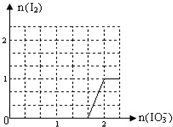
 已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).
已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知HF的共价键键能比HCl大,说明稳定性:HF>HCl | ||||
| B、已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 | ||||
C、已知 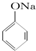 +SO2+H2O→ +SO2+H2O→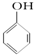 +Na2SO3,说明给出质子能力:HSO3->苯酚 +Na2SO3,说明给出质子能力:HSO3->苯酚 | ||||
D、已知CaCO3+SiO2
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).
已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).查看答案和解析>>
科目:高中化学 来源:2009年江苏省淮安市淮阴中学高考化学模拟试卷(三)(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com