


科目:高中化学 来源: 题型:
A、 配制一定物质的量浓度的稀硫酸 |
B、 制取少量的氢氧化铁胶体 |
C、 用硫酸标准溶液滴定氢氧化钠溶液 |
D、 称取氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:K+、Fe2+、MnO4-、SO42- |
| B、c(Fe3+)=0.1 mol?L-1的溶液中:K+、ClO-、SO42-、SCN- |
| C、c(H+)/c (OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D、与铝反应生成氢气的溶液中:NH4+、K+、Cl-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种溶液的pH不相同 |
| B、它们分别与足量CaCO3反应时,放出的CO2一样多 |
| C、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| D、分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 事 实 | 结 论 | |
| A | 常温下1mol?L-1醋酸的酸性比0.1mol?L-1醋酸强 | 弱酸的电离度随浓度的增大而增大 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaBr溶液中通入Cl2时,溶液变橙黄色 | 非金属性:Cl>Br |
| D | 盐酸酸性比氢硫酸(H2S的水溶液)强 | 非金属性:Cl>S |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
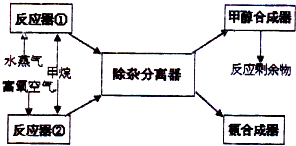 某化工厂以甲烷为主要原料来制取合成甲醇及合成氨的原料,其主要反应为:
某化工厂以甲烷为主要原料来制取合成甲醇及合成氨的原料,其主要反应为:| 2 |
| 3 |
| n(H2) |
| n(N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L0.25 mol/L的Na2SO4溶液中含氧原子个数为NA |
| B、12g石墨烯(单层)中含六元环的个数为0.5NA |
| C、78g苯含有碳碳双键数为3NA |
| D、电解精炼铜时每转移NA个电子,阳极溶解32g铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com