(2010?唐山三模)如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去,各装置可重复使用).请根据下列要求回答问题.
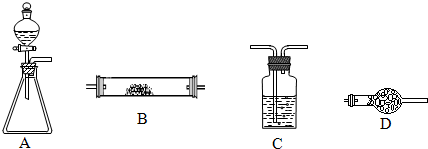
(1)若锥形瓶中盛装漂白粉固体,分液漏斗中盛装浓盐酸,则:
当仪器连接顺序为A→C→C→B→D时,B装置中为铝粉,制备少量无水三氯化铝.A中发生反应的化学方程式
4HCl+Ca(ClO)2=CaCl2+2Cl2↑+2H2O
4HCl+Ca(ClO)2=CaCl2+2Cl2↑+2H2O
,第二个C装置中盛装的试剂为
浓硫酸
浓硫酸
,D装置的作用是
除去尾气氯气,并防止空气中的水进入B装置
除去尾气氯气,并防止空气中的水进入B装置
.
(2)若锥形瓶中盛装足量的Na
2O
2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,则产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接顺序是(填字母)
A
A
→
D
D
→
B
B
→
D
D
;装置B中可能观察到的现象是
B装置中有红棕色气体出现
B装置中有红棕色气体出现
.
(3)若锥形瓶中为大理石,分液漏斗中为稀盐酸,B装置中为镁粉,为验证镁与二氧化碳的反应,仪器的连接顺序为A→C→C→B,第一个装置中的试剂名称为
饱和NaHCO3溶液
饱和NaHCO3溶液
,B中发生反应的化学方程式为
,在加热B装置之前,应该
打开分液漏斗的活塞,先通一段时间的二氧化碳
打开分液漏斗的活塞,先通一段时间的二氧化碳
.
(4)若锥形瓶中为二氧化锰固体,分液漏斗中为双氧水,B装置中为电石(只含杂质硫化钙),仪器的连接顺序为A→C→B→C→C,第二个C装置中为品红溶液,第三个C装置中为澄清石灰水,且实验后品红溶液红色明显变浅,澄清石灰水变浑浊,写出B中发生的可能反应
,
.若反应前B中样品质量为8.40g,反应后B中残留固体质量为7.28g,则电石中碳化钙的质量分数为
91.4%
91.4%
.(假设固体反应完全,结果保留三位有效数字).

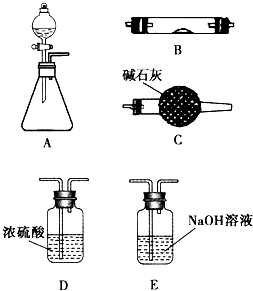 如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持装置均已略去).请根据下列要求回答问题.
如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持装置均已略去).请根据下列要求回答问题.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
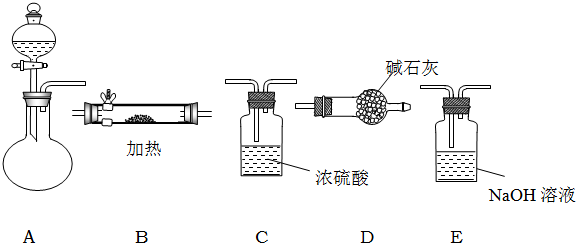
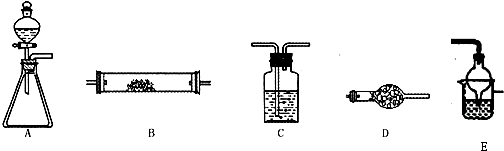
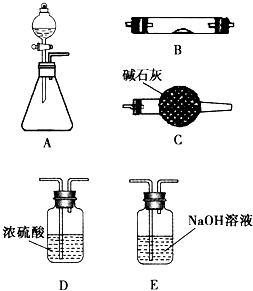 如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持装置均已略去).请根据下列要求回答问题.
如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持装置均已略去).请根据下列要求回答问题.