
分析 根据n=cV计算出混合液中硝酸钾、硝酸钡的物质的量,从而可知混合液中硝酸根离子的总物质的量,再根据c=$\frac{n}{V}$计算出混合溶液中NO3-物质的量浓度.
解答 解:50mL 0.50mol•L-1的硝酸钾溶液中硝酸钾的物质的量为:0.5mol/L×0.05L=0.025mol,0.025mol硝酸钾中含有0.025mol硝酸根离子,
50mL 0.40mol•L-1Ba(NO3)2的溶液中含有硝酸钡的物质的量为:0.4mol/L×0.05L=0.02mol,0.02mol硝酸钡中含有硝酸根离子的物质的量为:0.02mol×2=0.04mol,
混合过程中硝酸根离子的物质的量不变,则混合液中硝酸根离子的总物质的量为:0.025mol+0.04mol=0.065mol,
混合溶液中NO3-物质的量浓度为:c(NO3-)=$\frac{0.065mol}{0.1L}$=0.65mol/L,
答:混合溶液中NO3-物质的量浓度为0.65mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意溶液混合过程中溶质的物质的量不变,试题培养了学生的化学计算能力.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | “塑料王”聚四氟乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 三氯甲烷(CHCl3)可以用甲烷与氯气的取代反应来制取 | |
| C. | 四氟乙烯 (CF2=CF2)中所有的原子都在同一个平面上 | |
| D. | 四氟乙烯 (CF2=CF2)通过加聚反应生成“塑料王”聚四氟乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成物是HI和HClO | B. | 生成物是HCl和HIO | ||
| C. | 属于置换反应 | D. | 属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
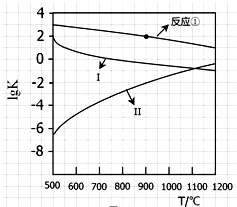 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4(g)的反应为放热反应 | |
| B. | 25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为2×10-5 | |
| C. | 在80℃时,测得某时刻,Ni(CO)4(g)、CO浓度均为0.5 mol/L,则此时v(正)>v(逆) | |
| D. | 80℃达到平衡时,测得n(CO)=0.15mol,则Ni(CO)4的平衡浓度为0.125 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质燃烧总是放热的 | |
| B. | 放热反应在反应发生时都不需要加热 | |
| C. | 热化学方程式中,化学式前的化学计量数仅表示物质的量 | |
| D. | 大多数化合反应是放热的,大多数分解反应是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+O2(气)═CO2(气)△H1 C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$ Cl2(气)═HCl(气)△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com