
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若X与Z的质子数之和为23。下列说法正确的是

A. X气态氢化物的水溶液呈酸性 B. 氧化物对应水化物的酸性:W>Z>X
C. Z、W简单离子半径Z>W D. W的单质具有漂白性,Z的氧化物不具有漂白性
【答案】C
【解析】X、Y、Z、W均为短周期元素,依据其所在表格中的相对位置知X、Y位于第二周期,Z、W位于第三周期,且X与Z的质子数之和为23,设X的质子数为a,则Y为a+1,Y为a+9,W为a+10,即a+(a+9)=23,解得:a=7,据此得出X为N,Y为O,Z为S,Z为S、W为Cl,据此判断各选项即可。
根据以上分析可知X为N,Y为O,Z为S、W为Cl,则
A.氮元素的氢化物氨气是碱性气体,其水溶液显碱性,A错误;
B.非金属性越强,最高价氧化物水化物的酸性越强,其它含氧酸则不一定,B错误;
C.离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则Z、W简单离子半径Z>W,C正确;
D.氯气不具有漂白性,溶于水生成的次氯酸具有漂白性,Z的氧化物二氧化硫具有漂白性,D错误;
答案选C。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素③的原子结构示意图______;元素⑨形成的氢化物的电子式___________。
(3)表中元素④、⑨形成的氢化物的稳定性顺序为_____> (填化学式)。
(4)表中元素⑧和⑨的最高价氧化物对应水化物的酸性强弱为_____> (填化学式)。
(5)表中元素③、④、⑥、⑦的原子半径大小为____> > > (填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用高温活性炭催化CO与C12合成光气(COCl2))。
(1)COCl2 中的原子最外层都达到 8电子稳定结构,光气分子的电子式为_____。
(2)工业上利用天然气(CH4)与CO2 进行高温重整制备CO的反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+247.3 kJ/mol。已知:C—H、C≡O、H—H键的键能依次为413 kJ·mol-1、1076 kJ·mol-1、436 kJ·mol-1,则 C=O键的键能为____kJ·mol-1。
(3)光气为窒息性毒剂,极易水解生成氯化氢,泄露后可用水雾吸收,化学方程式为:_______。
(4)某温度下,在2L恒容密闭容器中充入 2 mol CO(g)、2 mol Cl2(g)和适量的活性炭,发生反应:Cl2(g)+CO(g)![]() COCl2(g) ΔH=-108 kJ·mol-1,测得在混合气中COCl2的体积分数φ(COCl2)和时间t 的关系如图曲线Ⅰ所示。
COCl2(g) ΔH=-108 kJ·mol-1,测得在混合气中COCl2的体积分数φ(COCl2)和时间t 的关系如图曲线Ⅰ所示。
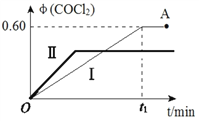
①下列情况不能表明该反应达到平衡状态的是_______(填字母标号)。
A.CO的体积分数不改变
B.Cl2的消耗速率与COCl2的生成速率相等
C.体系中![]() 不改变
不改变
D.混合气体的平均相对分子质量不再变化
②按曲线Ⅰ,平衡常数K=____。A点时,向容器中加入等物质的量CO和Cl2,再次达到平衡时,光气的体积分数会 ______(填“增大”、 “减小”或“不变”。
③曲线Ⅱ相对曲线Ⅰ改变的条件可能是_______(填字母标号)。
A.恒容通入惰性气体 B.通入 CO
C.增大压强 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下图转化关系,试推断回答下列问题。
(1)D元素原子的结构示意图为;
(2)A、B、C三种元素的原子半径由小到大的顺序为(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为;
(4)A的气态氢化物的电子式 ;
(5)实验室中,制取A的气态氢化物的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3<HClO<HF
B. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
C. 若将CO2通入0.lmol/LNa2C03溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L
D. 向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究 , 其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol分枝酸最多可与3 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. HS-的水解方程式为:HS-+ H2O![]() H3O++S2-
H3O++S2-
B. CH3COOH 溶液加水稀释后,溶液中![]() 的值减小
的值减小
C. 将pH =4的盐酸稀释后,溶液中所有离子的浓度均降低
D. 100℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素a、b、c、d、e为前20号主族元素,原子序数依次增大。b元素原子最外层电子数与核外电子总数之比为2:3;c的氢化物能与其最高价氧化物对应的水化物反应生成一种盐;a与b、c均可以形成电子总数为10的分子;d元素的氧化物能使品红溶液褪色,且加热后品红颜色复原;e原子是前20号主族元素中原子半径最大的。请回答:
(1)e元素在周期表中的位置_______________。
(2)bd2的电子式_______________;e2d的电子式_______________;ca3的空间构型_______________。
(3)e的最高价氧化物的水化物所含化学键类型为______________、_______________,晶体类型为_______________。其溶液与b的最高价氧化物反应的离子方程式为____________________________。
(4)在常温常压下,1g b的最简单气态氢化物完全燃烧放出的热量约为56kJ,写出该反应的热化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰火让国庆70周年联欢会更加辉煌壮观,这些五彩缤纷的焰火与元素的焰色反应有关。下列说法不正确的是
A.观察K2SO4的焰色应透过蓝色的钴玻璃
B.Na与NaCl在灼烧时火焰颜色相同
C.可以用焰色反应来区别NaCl和KCl
D.焰色反应一定发生化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com