
【题目】![]() 的分解受多种因素的影响。实验测得
的分解受多种因素的影响。实验测得![]() 时不同条件下,
时不同条件下,![]() 浓度随时间变化如图所示,下列说法不正确的是
浓度随时间变化如图所示,下列说法不正确的是
A.图甲表明,其他条件相同时,![]() 的浓度越小,其分解速率越慢
的浓度越小,其分解速率越慢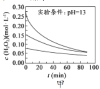
B.图乙表明,其他条件相同时,溶液pH越小,![]() 分解速率越慢
分解速率越慢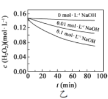
C.图丙表明,少量![]() 存在时,溶液碱性越强,
存在时,溶液碱性越强,![]() 分解速率越快
分解速率越快
D.图丙和图丁表明,碱性溶液中,![]() 对
对![]() 分解速率的影响大
分解速率的影响大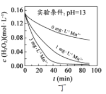
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)= CH3OH(l)△H=-37.3 kJ/mol,则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H=_______kJ/mol。
CH3OH(g)+H2O(l)△H=_______kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0 L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 M Pa和5.0 MPa下CO2转化率随温度的变化关系。
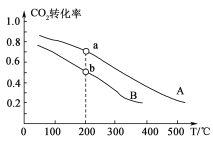
①其中a点的平衡常数表达式为:_________________。
②a,b两点化学反应速率分别用va、vb表示,则va________vb (填“大于”、“小于”或“等于”)。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。
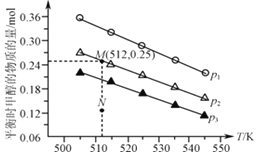
A. 该反应的正反应为放热反应
B. 压强大小关系为p1<p2<p3
C. M点对应的平衡常数K的值约为1.04×10-2
D. 在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用![]() 生产甲醇
生产甲醇
(4)已知:CO(g)+2H2(g)![]() CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
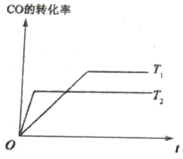
①该反应的焓变△H ______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_________K2(填“>”“<”或“=”)。
Ⅲ.甲醇的应用
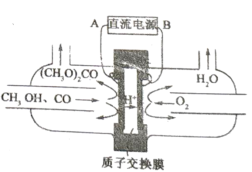
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.激素类药物乙烯雌酚的结构简式为: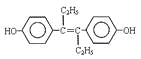 ,它的分子式是:C18H20O2
,它的分子式是:C18H20O2
B.等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量依次减少
C.聚乳酸(![]() )是由单体之间通过加聚反应合成的
)是由单体之间通过加聚反应合成的
D.实验证实![]() 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 图甲表示可逆反应A(g)+2B(g)2C(g),速率随外界条件的改变曲
B. 图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图丙表示用0.1mol/L NaOH溶液滴定20.00mL 0.1mol/LCH3COOH溶液得到的滴定曲线
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g)相同时间后测得NO2含量的曲线,则该反应的△H<0 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1) X在元素周期表中的位置为_______;画出X的简单离子结构示意图_______。
已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_____________。
(2)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为_______>________(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为______ 。
(5)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验事实及其解释都正确的是( )
A. 过量的铜屑与稀硝酸作用,反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解是因为铜 可直接与1 mol/L稀硫酸反应
B. 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C. 铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面 形成了一层致密稳定的氧化膜
D. 工业制玻璃的主要反应之一:Na2CO3+SiO2高温Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则下列说法正确的是
A.实现该变化的只能是升高温度B.溶液的导电能力一定变强
C.溶液的pH一定减小D.发生电离的分子总数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq)△H<0
H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
A. 298K时,加蒸馏水稀释HF溶液, ![]() 保持不变
保持不变
B. 308K时,HF的电离常数Ka>3.5×10-4
C. 298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq)K≈0.68
CaF2(s)+2H+(aq)K≈0.68
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
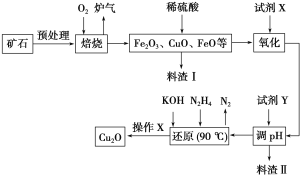
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com