
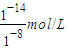 =10-6 mol/L,0.1mol?L-1NaOH溶液中c(H+)等于由水电离出的氢氧根离子浓度,即c(H+)=c(OH-)(水电离出的)=
=10-6 mol/L,0.1mol?L-1NaOH溶液中c(H+)等于由水电离出的氢氧根离子浓度,即c(H+)=c(OH-)(水电离出的)=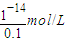 =10-13 mol/L,所以混合液中由水电离出的OH-浓度与0.1mol?L-1NaOH溶液中由水电离出的OH-浓度之比=10-6 mol/L:10-13 mol/L=107:1,故答案为:107:1;
=10-13 mol/L,所以混合液中由水电离出的OH-浓度与0.1mol?L-1NaOH溶液中由水电离出的OH-浓度之比=10-6 mol/L:10-13 mol/L=107:1,故答案为:107:1; ×0.1mol?L-1=0.05mol?L-1,;[H+]=[OH-]=1×10-7 mol?L-1(因为是25℃下且为中性),故混合后溶液中c(NH3.H2O)=
×0.1mol?L-1=0.05mol?L-1,;[H+]=[OH-]=1×10-7 mol?L-1(因为是25℃下且为中性),故混合后溶液中c(NH3.H2O)= ×amol?L-1-0.05mol?L-1=(0.5a-0.05)mol/L,NH3?H2O的电离常数Kb=
×amol?L-1-0.05mol?L-1=(0.5a-0.05)mol/L,NH3?H2O的电离常数Kb= mol/L=
mol/L=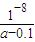 mol/L,
mol/L,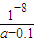 .
.

 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 10-8 |
| a-0.1 |
| 10-8 |
| a-0.1 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省滨州市高三第一次(3月)模拟考试理综化学试卷(解析版) 题型:计算题
(l)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为 。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1mol·L-1硫酸铝溶液
②0.1mol·L-1氯化钡溶液③蒸馏水④0.1mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是 。(用序号填写)
(3)常温下,将a mol·L-1的氨水与0.1mol·L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数 =
mol·L-1。
=
mol·L-1。
查看答案和解析>>
科目:高中化学 来源:滨州一模 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com