
��֪��ͼ��ʾ�Ŀ��淴Ӧ��
A(g)+B(g)![]() 2C(g) +D(g)����H = Q kJ/mol
2C(g) +D(g)����H = Q kJ/mol
 ��ش��������⣺
��ش��������⣺
��1��Q 0���>������<����=����
��2����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊ��
c(A)= 1.0 mol/L�� c(B)=2.0 mol/L ���ﵽƽ���
A��ת����Ϊ50����
��ʱB��ת����Ϊ ��
��3������Ӧ�¶����ߣ�A��ת����
���������С�����䡱����
��4������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)= 3 .0mol/L,
c(B)= a mol/L���ﵽƽ���c(D)=1.0 mol/L��a= ��
��5����Ӧ��ϵ�м����������Ӧ����������E1�ı仯�ǣ�E1_______����H�ı仯�ǣ���H________���������С�������䡱����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��12�֣���֪��ͼ��ʾ�Ŀ��淴Ӧ�� A(g)+B(g) 2C(g) +D(g)����H = Q kJ/mol
2C(g) +D(g)����H = Q kJ/mol
��ش��������⣺
��1��Q 0���>������<����=����
��2����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)= 1.0 mol/L�� c(B)=2.0mol/L ���ﵽƽ���A��ת����Ϊ50������ʱB��ת����Ϊ ��
��3������Ӧ�¶����ߣ�A��ת���� ���������С�����䡱����
��4������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)= 3 .0mol/L,
c(B)= a mol/L���ﵽƽ���c(D)=1.0 mol/L��a= ��
��5����Ӧ��ϵ�м����������Ӧ����������E1�ı仯�ǣ�E1_______����H�ı仯�ǣ���H________���������С�������䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꼪��ʡ������ʮһ���и�һ��ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
��12�֣���֪��ͼ��ʾ�Ŀ��淴Ӧ��A(g)+B(g) C(g)+D(g) ��H =" Q" kJ/mol
C(g)+D(g) ��H =" Q" kJ/mol
��ش��������⣺
��1��Q 0���>������<����=������
��2����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)=" 1.0" mol/L��c(B)="2.0" mol/L ���ﵽƽ���A��ת����Ϊ50������ʱB��ת����Ϊ ��
��3������Ӧ�¶����ߣ�A��ת���� ���������С�����䡱����
��4������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)="3.0" mol/L,c(B)=" a" mol/L���ﵽƽ���c(D)="1.0" mol/L����a= ��
��5����Ӧ��ϵ�м����������Ӧ����������E1�ı仯�ǣ�E1 ���������С�������䡱������H�ı仯�ǣ���H ���������С�������䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�켪��ʡ�����и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��12�֣���֪��ͼ��ʾ�Ŀ��淴Ӧ��A(g)+B(g) C(g)+D(g) ��H = Q kJ/mol
C(g)+D(g) ��H = Q kJ/mol
��ش��������⣺
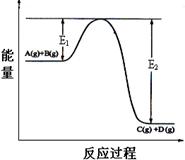
��1��Q 0���>������<����=������
��2����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)= 1.0 mol/L��c(B)=2.0 mol/L ���ﵽƽ���A��ת����Ϊ50������ʱB��ת����Ϊ ��
��3������Ӧ�¶����ߣ�A��ת���� ���������С�����䡱����
��4������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)=3.0 mol/L,c(B)= a mol/L���ﵽƽ���c(D)=1.0 mol/L����a= ��
��5����Ӧ��ϵ�м����������Ӧ����������E1�ı仯�ǣ�E1 ���������С�������䡱������H�ı仯�ǣ���H ���������С�������䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ĸ߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��12�֣���֪��ͼ��ʾ�Ŀ��淴Ӧ�� A(g)+B(g) 2C(g) +D(g)����H = Q kJ/mol
2C(g) +D(g)����H = Q kJ/mol
��ش��������⣺

��1��Q 0���>������<����=����
��2����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)= 1.0 mol/L�� c(B)=2.0 mol/L ���ﵽƽ���A��ת����Ϊ50������ʱB��ת����Ϊ ��
��3������Ӧ�¶����ߣ�A��ת���� ���������С�����䡱����
��4������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)= 3 .0mol/L,
c(B)= a mol/L���ﵽƽ���c(D)=1.0 mol/L��a= ��
��5����Ӧ��ϵ�м����������Ӧ����������E1�ı仯�ǣ�E1_______����H�ı仯�ǣ���H________���������С�������䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��ͼ��ʾ�Ŀ��淴Ӧ��A(g)+B(g)![]() C(g)+D(g) ��H = Q kJ/mol
C(g)+D(g) ��H = Q kJ/mol
��ش��������⣺
��1��Q�� ������0���>������<����=������
��2����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)= 1.0 mol/L��c(B)=2.0 mol/L ���ﵽƽ���A��ת����Ϊ50������ʱB��ת����Ϊ�� ���� ��
��3������Ӧ�¶����ߣ�A��ת���� ���� ���������С�����䡱����
��4������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊ��c(A)=3.0 mol/L,c(B)= a mol/L���ﵽƽ���c(D)=1.0 mol/L����a=���� ���� ��
��5����Ӧ��ϵ�м����������Ӧ����������E1�ı仯�ǣ�E1������������ ���������С�������䡱������H�ı仯�ǣ���H���� ���������С�������䡱����

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com