

 N2+2CO2
N2+2CO2 N2+2CO2
N2+2CO2

科目:高中化学 来源:不详 题型:单选题
| A.Cl2能与金属活动性顺序表中大多数金属反应 |
| B.N2是大气中的主要成分之一,雷雨时,可一步转化为NO2 |
| C.硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性 |
| D.硅是应用广泛的半导体材料,常温下化学性质活泼 |
查看答案和解析>>
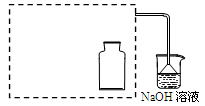
科目:高中化学 来源:不详 题型:实验题
| 操作 | 现象 |
| a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 | |
| b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在接触室中使用铁粉作催化剂 |
| B.在接触室中运用热交换技术可充分利用能源 |
| C.把硫铁磨成细粉末,可以提高原料的利用率 |
| D.该反应采用450~500℃主要是因为该温度下催化剂活性好 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.X可能含有2种盐 | B.a是SO3 |
| C.Y可能含(NH4)2SO4 | D.(NH4)2S2O8中S元素的化合价不可能为+7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
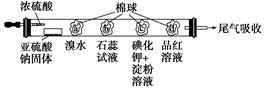
| 选项 | 现象 | 解释或结论 |
| A | a处黄色褪去 | 非金属性:Br>S |
| B | b处变为红色 | 二氧化硫与水反应生成酸性物质 |
| C | c处变为蓝色 | 二氧化硫具有一定的氧化性 |
| D | d处红色先褪去后恢复 | 二氧化硫具有漂白性且漂白性不稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
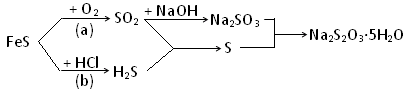
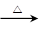 2Fe2O3+4SO2、Na2SO3+S
2Fe2O3+4SO2、Na2SO3+S Na2S2O3
Na2S2O3| | 第一份 | 第二份 | 第三份 |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.80 | 1.60 | 3.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com