
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH02 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
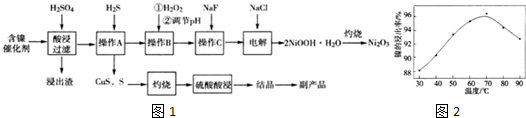
分析 (1)含镍催化剂中含有Fe2O3、CaO、CuO、BaO等杂质,能和稀硫酸反应生成白色沉淀且最难溶的为硫酸钡;
(2)由于随着温度升高,Ni2+的水解程度增大,从而导致镍的浸出率降低,浸出渣中Ni(OH)2含量增大;
(3)产物中的难容与水的固体CuS、S的分离方法为过滤,加入H2O2,使溶液中的Fe2+氧化为Fe3+,调节pH使得Ni2+沉淀,三价铁不能沉淀,根据表格数据可知,pH范围为3.7-7.7之间,加氟化钠的目的是除去溶液中的钙离子;
(4)Ni2+被ClO-氧化产生2NiOOH•H2O沉淀,其还原产物是氯离子,33.2gNi2O3为0.2mol,二价镍离子变为+3价镍0.2molNi2O3,转移电子的物质的量为0.4mol,数目为0.4NA,即2.41×1023 .
解答 解(1)含镍催化剂中含有Fe2O3、CaO、CuO、BaO等杂质,能和稀硫酸反应生成白色沉淀且最难溶的为硫酸钡,故答案为:BaSO4;
(2)由于随着温度升高,Ni2+的水解程度增大,从而导致镍的浸出率降低,浸出渣中Ni(OH)2含量增大,故答案为:温度升高,Ni2+的水解程度增大;
(3)产物中的难容与水的固体CuS、S的分离方法为过滤,加入H2O2,使溶液中的Fe2+氧化为Fe3+,调节pH使得Ni2+沉淀,三价铁不能沉淀,根据表格数据可知,pH范围为3.7-7.7之间,加氟化钠的目的是除去溶液中的钙离子;
故答案为:过滤;3.7-7.7;除去溶液中的钙离子;
(4)Ni2+被ClO-氧化产生2NiOOH•H2O沉淀,其还原产物是氯离子,33.2gNi2O3为0.2mol,二价镍离子变为+3价镍0.2molNi2O3,转移电子的物质的量为0.4mol,数目为0.4NA,即2.41×1023,
故答案为:ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-;2.41×1023.
点评 该题以废旧含镍催化剂生产Ni2O3为载体,重点考查学生对工艺流程试题了解掌握情况,试题综合性强,贴近高考,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力以及动手操作能力,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
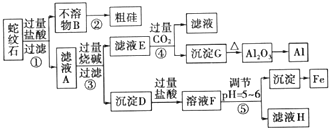
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则其在周期表中的位置是第四周期,第ⅤA族.
,则其在周期表中的位置是第四周期,第ⅤA族.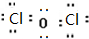 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
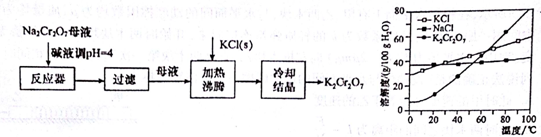
 Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.
Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | t (℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.8×10-3 | 82 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com