

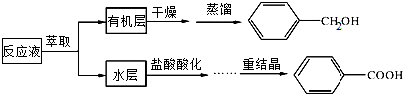
分析 (1)根据苯甲醇易溶于乙醚,且乙醚与水互不相溶分析,加入盐酸可生成苯甲酸,经重结晶析出;
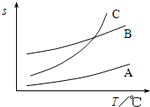
(2)应选择溶解度随温度变化较大的试剂,趁热过滤可除去杂质;
(3)发生中和反应,根据c(酸)×V(酸)=c(碱)×V(碱)计算.
解答 解:(1)苯甲醇易溶于乙醚,且乙醚与水互不相溶,可用乙醚作为萃取剂,分液时,应从下口放出下层液体,从上口倒出上层液体,加入盐酸可生成苯甲酸,经重结晶析出,
故答案为:乙醚;从下口放出下层液体,从上口倒出上层液体;将苯甲酸钠转化为苯甲酸,析出晶体;
(2)应选择试剂C,原因是在溶剂C中随温度变化苯甲酸的溶解度变化较大,有利于重结晶分离,分离时要趁热过滤,可除去不溶性杂质,防止苯甲酸冷却后结晶析出,洗涤时可用蒸馏水,防止引入其它杂质,
故答案为:C;随温度变化苯甲酸的溶解度变化较大;除去不溶性杂质,防止苯甲酸冷却后结晶析出;
(3)n(NaOH)=0.1000mol/L×24.5×10-3L=2.45×10-3mol,
则试样中苯甲酸的物质的量为:2.45×10-3mol×$\frac{100}{25}$=9.8×10-3mol,
质量为:9.8×10-3mol×122g/mol=1.1956g,
试样中苯甲酸的含量为:$\frac{1.1956g}{1.22g}$=98%,
故答案为:98%.
点评 本题考查探究物质组成、测量物质含量的方法,题目难度中等,试题侧重于学生实验设计和评价能力的考查,注意把握实验原理和实验基本操作方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏都属于化学变化 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察其是否变蓝 | |
| D. | 铝制容器不宜用来长时间存放酸性和碱性食物,也不可长时间存放含盐腌制食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 原子晶体中,共价键的键长越短,键能越大,熔点就越高 | |
| C. | 分子晶体中,共价键键能越大,该分子的熔沸点就越高 | |
| D. | 分子晶体中,分子间作用力越大,则分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 通过灼热的铜网以除去H2中混有的O2 | |
| C. | Cu与浓硫酸反应终止后,冷却,向试管中加适量蒸馏水以观察水合铜离子的颜色 | |
| D. | 用广泛pH试纸测得某溶液的pH为3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14组 | B. | 20组 | C. | 26组 | D. | 32组 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com