
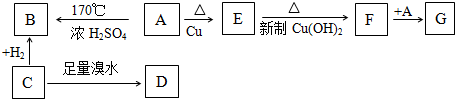
分析 有机物 A 是酒的主要成份,则A为CH3CH2OH,A在浓硫酸加热到170℃时生成B为CH2=CH2,C 可以用于焊接金属,C与氢气加成得B,则C为CH≡CH,C与足量的溴水加成得D为CHBr2CHBr2,A在铜作催化剂的条件下发生氧化生成E,E能与新制的氢氧化铜反应,则E为CH3CHO,E氧化得F为CH3COOH,F与乙醇生酯化反应得G为CH3COOCH2CH3,据此答题.
解答 解:有机物 A 是酒的主要成份,则A为CH3CH2OH,A在浓硫酸加热到170℃时生成B为CH2=CH2,C 可以用于焊接金属,C与氢气加成得B,则C为CH≡CH,C与足量的溴水加成得D为CHBr2CHBr2,A在铜作催化剂的条件下发生氧化生成E,E能与新制的氢氧化铜反应,则E为CH3CHO,E氧化得F为CH3COOH,F与乙醇生酯化反应得G为CH3COOCH2CH3,
(1)G为CH3COOCH2CH3,G的名称是乙酸乙酯,
故答案为:乙酸乙酯;
(2)工业上用乙烯与水加成合成 乙醇,反应 的化学方程式是CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;
(3)写出下列物质转化的化学方程式,并指出反应类型:
①C→D的化学方程式为:CH≡CH+2Br2→CHBr2CHBr2,反应类型是加成反应,②E→F的化学方程式为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,反应类型是氧化反应,③F→G的化学方程式为CH3COOH+HOC2H5$→_{△}^{浓硫酸}$CH3COOC2H5+H2O,属于取代反应,
故答案为:CH≡CH+2Br2→CHBr2CHBr2;加成反应;CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O;氧化反应;CH3COOH+HOC2H5$→_{△}^{浓硫酸}$CH3COOC2H5+H2O;取代反应.
点评 本题考查有机物推断,涉及烯、炔、卤代烃、醇、醛、羧酸、酯之间的转化关系等,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol A 从酸中置换H+生成的H2比1 mol B从酸中置换H+生成的H2多 | |
| B. | 常温时,A能从水中置换出氢,而B不能 | |
| C. | A原子的最外层电子数比B原子的最外层电子数少 | |
| D. | A原子电子层数比B原子的电子层数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 金属钠与水反应 | Na+H2O→Na++OH-+H2↑ | 错误,未配平 |
| B | 漂白粉溶液中 通入过量CO2 | Ca2++2ClO-+H2O+CO2→ CaCO3↓+2HClO | 正确 |
| C | 醋酸铵溶液中 加入盐酸 | CH3COONH4+H+→ CH3COOH+NH4+ | 错误,醋酸铵不应写成化学式 |
| D | NaHCO3溶液 呈碱性 | HCO3-+H2O?H2CO3+OH- | 错误,应放出CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 现象 | 结论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液. | NaOH溶液部分变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com