
| A. | Ca | B. | Li | C. | K | D. | Na |
科目:高中化学 来源: 题型:选择题
| A. | 蒸发结晶时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,溶液的液面高于滤纸的边缘 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从上口倒到另一个烧杯中 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ正(NH3)=υ正(H2S) | B. | υ正(NH3)=υ逆(H2S) | C. | υ逆(NH3)=υ逆(H2S) | D. | υ(NH3)=υ(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
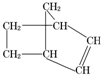 降冰片烯的分子结构如图:
降冰片烯的分子结构如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数等于或大于3(小于8)的元素一定是主族元素 | |
| B. | 元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱 | |
| C. | 在主族元素中,最高正化合价均等于主族序数 | |
| D. | 元素的原子得电子越多,非金属性越强;失电子越多,金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
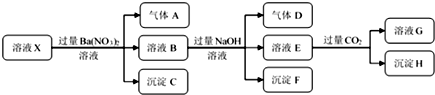
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3,工业上往BaCO3中加入饱和的Na2CO3可以实现BaSO4的转变 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硼的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt见光容易分解,但不溶于水也不溶于稀酸 | |
| C. | 氢氧化铷(RbOH)易溶于水 | |
| D. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com