氮及其化合物在工农业生产、生活中有者重要作用.请回答下列问题:
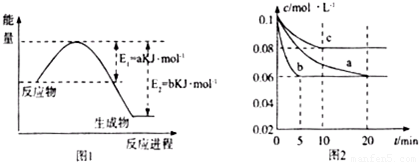
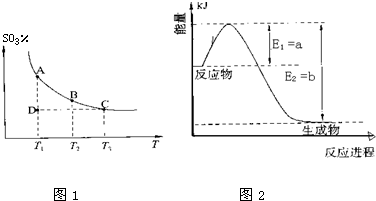
(1)图1是1molNO
2和1mol CO反应生成CO
2和NO过程中能星变化示意图(a、b均大 于0>,且知:
2CO(g)+2NO(g)=N
2(g)+2CO
2(g)△H=-ckJ?mol
-1(c>0)
请写出CO将NO
2还原至N
2时的热化学方程式______;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N
2的浓度随时间的变化曲线(以a、b、c表示).已知三个条件下起始加入浓度均为:c(N
2)=0.1mol?L
-1,c(H
2)=0.3mol?L
-1;合成氨的反应:N
2(g)+3H
2(g)?2NH
3(g)△H<0
①计算在a达平衡时H
2的转化率为______;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是______;试写出判断b与a条件不同的理由______;
(3)利用图2中c条件下合成氨(容积固定).已知化学平衡常数K与温度(T)的关系如 下表:
| T/(K) | 298 | 398 | 498 | … |
| K/-2 | 4.1×106 | K1 | K2 | … |
①试确定K
1的相对大小,K
1______4.1x10
6(填写“>”“-”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是______ (填序号字母).
A.容器内NH
3的浓度保持不变 B.2v( N
2)(正)-v( H
2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH
4Cl溶液呈酸性的原因是(用离子反应方程式表示)______.
②25°C时,将PH=x氨水与pH=y的疏酸(且x+y-14,x>11 )等体积混合后,所得溶液 中各种离子的浓度关系正确的是
A.[SO

]>[NH

]>[H
+]>[OH
-]
B.[NH

]>[SO

]>[OH
-]>[H
+]
C.[NH

]+[H
+]>[SO

]+[OH
-]
D.[NH
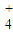
]>[SO

]>[H
+]>[OH
-].


 ]>[NH
]>[NH ]>[H+]>[OH-]
]>[H+]>[OH-] ]>[SO
]>[SO ]>[OH-]>[H+]
]>[OH-]>[H+] ]+[H+]>[SO
]+[H+]>[SO ]+[OH-]
]+[OH-] ]>[SO
]>[SO ]>[H+]>[OH-].
]>[H+]>[OH-].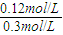 ×100%=40%,
×100%=40%,

 2NH3(g)
2NH3(g) [N2H5?H2O]++H+
[N2H5?H2O]++H+ [N2H5?H2O]++H+
[N2H5?H2O]++H+

 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=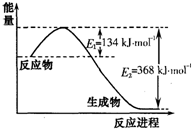 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: