
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH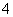 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO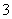 、SO
、SO 、CO
、CO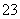 ,已知:
,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是__________________。
(2)D的化学式为__________________,D溶液显碱性的原因是________________________(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是_______________________________;
E和氨水反应的离子方程式是____________________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是___________________________。
答案 (1)Cu2+、Fe3+ (NH4)2SO4、Al2(SO4)3
(2)Na2CO3 CO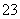 +H2OHCO
+H2OHCO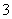 +OH-
+OH-
(3)Ag++Cl-===AgCl↓ Al3++3NH3·H2O===Al(OH)3↓+3NH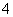
(4)取少量B于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,观察是否变蓝色
解析 由于盐溶液没有颜色,所以没有Cu2+和Fe3+;根据实验现象可知,A、B、C、D、E分别为BaCl2、(NH4)2SO4、AgNO3、Na2CO3、Al2(SO4)3;检验NH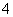 ,常用的方法是将铵盐与浓NaOH溶液共热,看是否能够产生使湿润的红色石蕊试纸变蓝的气体。
,常用的方法是将铵盐与浓NaOH溶液共热,看是否能够产生使湿润的红色石蕊试纸变蓝的气体。


科目:高中化学 来源: 题型:
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO 浸出液
浸出液
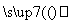
②
滤液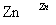
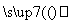 滤液
滤液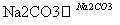
 滤饼
滤饼 ZnO
ZnO
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有______________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2,取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在水溶液中能大量共存的一组离子是( )
A.Na+、Ba2+、Cl-、NO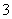
B.Pb2+、Hg2+、S2-、SO
C.NH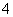 、H+、S2O
、H+、S2O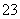 、PO
、PO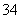
D.Ca2+、Al3+、Br-、CO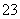
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol·L-1 NaOH溶液:K+、Ba2+、Cl-、HCO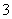
B.0.1 mol·L-1Na2CO3溶液:K+、NH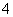 、NO
、NO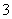 、SO
、SO
C.0.1 mol·L-1FeCl3溶液:K+、Na+、I-、SCN-
D.0.1 mol·L-1HCl的溶液:Ca2+、Na+、ClO-、NO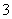
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,属于电解质的是________,属于非电解质的是________;属于强电解质的是________,属于弱电解质的是________。
①H2SO4 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜
⑦冰醋酸 ⑧氯化氢 ⑨蔗糖 ⑩氨气 ⑪CO2
⑫NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO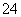 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
B.酸性介质中KMnO4氧化H2O2:2MnO +5H2O2+6H+===2Mn2++5O2↑+8H2O
+5H2O2+6H+===2Mn2++5O2↑+8H2O
C.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-===PbO2+4H++SO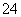
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.向100 mL 0.1 mol·L-1的FeSO4溶液中加入0.01 mol Na2O2固体:2Fe2++2Na2O2+2H2O===4Na++2Fe(OH)2+O2↑
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO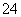 恰好沉淀完全:2Al3++3SO
恰好沉淀完全:2Al3++3SO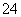 +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
C.在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应:NH3·H2O+SO2===NH +HSO
+HSO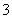
D.向20 mL 0.5 mol·L-1 FeBr2溶液中通入448 mL Cl2(标准状况):2Fe2++4Br-+3Cl2===2Fe3++6Cl-+2Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素
B.它是第6周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com