
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA
B.46gNO2和N2O4混合气体中含有原子总数为3NA
C.标准状况下,22.4LSO3中含有的分子数为NA.
D.1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA
科目:高中化学 来源: 题型:选择题
| A. | 1 mol青石棉能使1 mol稀硝酸被还原 | |
| B. | 青石棉中含有一定量的石英晶体 | |
| C. | 青石棉属于新型无机非金属材料 | |
| D. | 青石棉不属于硅酸盐原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
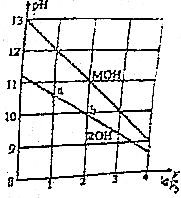 0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )
0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )| A. | ROH的电离方程式为ROH═R++OH- | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 等pH的ROH和MOH溶液,则MOH的浓度低 | |
| D. | 当1gV/V0=2时,若两溶液同时升高温度,则C(R+)增大,C(M+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳极的离子 和电极反应式 | 阴极的离子 和电极反应式 | 电解总反应式 | 溶液浓度变化 | 溶液pH的变化 | |
| HCl | 2Cl--2e-=Cl2↑ | 2H++2e-=H2↑ | 2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑ | 减小 | 增大 |
| CuBr2 | 2Br--2e-=Br2 | Cu2++2e-=Cu | 2Br-+Cu2+$\frac{\underline{\;通电\;}}{\;}$Br2+Cu | 减小 | 增大 |
| KCl | 2Cl--2e-=Cl2↑ | 2H++2e-=H2↑ | 2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | 减小 | 增大 |
| CuSO4 | 4OH--4e-=O2↑+2H2O | Cu2++2e-=Cu | 2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | 减小 | 增大 |
| NaOH | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 增大 |
| H2SO4 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 减小 |
| KNO3 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 不变 |
| Na2SO4 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 不变 |
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:选择题
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为2mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加3.4g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为5.6g
B.参加反应的硝酸的物质的量为0.2mol
C.沉淀完全时消耗NaOH溶液的体积为200mL
D.标况下产物NO体积为4.48L
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:填空题
典型金属元素及化合物的特征性质有着重要的应用,请按要求回答:
(1)Na、Al、Fe、Cu四种元素的单质中:
①Al与NaOH溶液反应的离子方程式是____________,其中作氧化剂的是_______。
②Cu在潮湿的空气中被腐蚀的化学方程式是_______________。
(2)上述四种金属的氧化物中:
①写出能用作供氧剂的一个化学方程式:___________________。
②既能溶于酸溶液又溶于强碱溶液,写出溶于强碱溶液的离子方程式_______________。
③常温下为黑色固体的是_________________。
(3)上述四种金属的氢氧化物中:
①易在空气中被氧化的现象是_______________。
②具有两性的是_________________。
(4)上述四种金属形成的阳离子共__________有种,其中既能表现还原性,又能表现氧化性的是__________;其中氧化性最强的是__________。
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
物质的量之比为2:5的锌和稀硝酸反应若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B. 1:5 C. 2:3 D. 2:5,
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. c(I-)=0.1mol.L-1的溶液中:K+、Na+、SO42-、ClO-
B.使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl-
C.与Al反应能放出大量H2的溶液中:Cl-、Na+、NO3-、Fe2+
D.由水电离出的c(OH-)=1×10--10mol.L-1的溶液中:Ba2+、K+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期期中化学试卷(解析版) 题型:选择题
化学与人类生产、生活、社会可持续发展密切相关。下列有关说法正确的是
A.MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al
B.水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C.医疗上用的“钡餐”其成分是碳酸钡,漂白粉的成分为次氯酸钙;
D.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com