C
分析:A、根据金属、氢气和沉淀之间的关系式得沉淀质量=金属质量+氢氧根质量.
B、根据恰好使沉淀达到最大值,且沉淀质量为dg.反应后溶液的成分为NaCl,根据酸和碱以1:1反应判断酸和碱的物质的量之间的关系.
C、设合金中含有xmolMg,ymolAl,根据生成氢气的物质的量和金属的质量可列方程组计算合金中镁和铝的物质的量,根据镁和铝的物质的量金属其质量;
D、总盐酸的物质的量减去生成氢气所用盐酸的物质的量即为剩余盐酸的物质的量.
解答:设合金中含有xmolMg,ymolAl,反应的化学方程式分别为:Mg+2HCl═MgCl
2+H
2↑,2Al+6HCl═2AlCl
3+3H
2↑,产生b mol H
2,

,所以
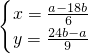
.
A、再向反应后的溶液中加入C
2mol?L
-1、V
2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg,
根据Mg~H
2~Mg(OH)
2,Al~1.5H
2~Al(OH)
3,反应生成沉淀的质量等于金属的质量加氢氧根离子的质量,而氢氧根离子的物质的量等于2n(H
2),则d=a+2b×17=a+34b,故A正确.
B、反应后溶液的成分为NaCl,则C
1×V
1=C
2×V
2,故B正确.
C、铝的质量为
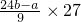
=3(24b-a)g,故C错误.
D、生成bmolH
2,则消耗盐酸2bmol,则剩余HCl为(c
1V
1-2b)mol,故D正确.
故选C.
点评:本题考查混合物的计算,题目难度较大,本题利用守恒的方法计算.

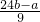 g
g ,所以
,所以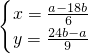 .
.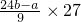 =3(24b-a)g,故C错误.
=3(24b-a)g,故C错误.

 阅读快车系列答案
阅读快车系列答案 g
g