
N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g):
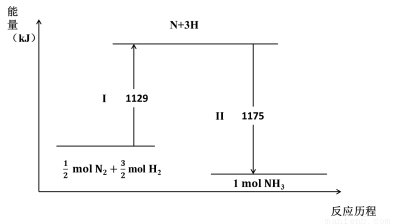
下列说法不正确的是
A.Ⅰ过程中破坏的均为非极性键
B.Ⅰ过程吸收能量,II过程放出能量
C. N2(g) + 3H2(g) 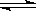 2NH3(g) ΔH = –44 kJ·mol-1
2NH3(g) ΔH = –44 kJ·mol-1
D.1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:选择题
反应C(s)+H2O?CO(g)+H2(g)△H>0,达到平衡时,下列说法正确的是
A.加入催化剂,平衡常数不变
B.减小容器体积,正、逆反应速率均减小
C.增大C的量,H2O的转化率增大
D.升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源:2017届北京市丰台区高三上学期期末化学试卷(解析版) 题型:实验题
含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计)。
①阳极材料是_________。
②阴极的电极反应式是_________;电解总反应为:_________。
(2)还原法
①工业上可用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为_________。
②控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是_________。
Ⅱ.利用Cu2O光催化处理含有Cr2O72-的废水的研究。
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如下图所示。
在图中用短线和箭头画出电子移动的方向,写出Cr2O72-转化Cr3+的电极反应_________。
(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O 与Cr2O72-发生氧化还原反应。
已知:Cu2O的添加量是1.74×10-4 mol/L,Cr2O72-的初始浓度是9.60×10-4 mol/L;对比实验,反应1.5小时结果如下图所示。结合试剂用量数据和实验结果可得到的结论和依据是_______。
(3)溶液的pH对Cr2O72-降解率的影响如下图所示。
已知:Cu2O 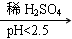 Cu +CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu +CuSO4;酸性越大,Cr2O72-被还原率越大。
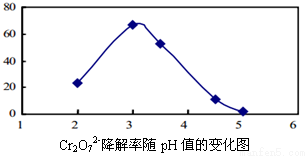
①由上图可知,pH分别为2、3、4时,Cr2O72-的降解率最好的是_________,其原因是_________。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,Cr2O72-的降解率低的原因是_______。
查看答案和解析>>
科目:高中化学 来源:2017届北京市丰台区高三上学期期末化学试卷(解析版) 题型:选择题
下列生活中常见的现象中,其反应原理不涉及氧化还原反应的是
A.铁的冶炼 | B.电池放电 | C.碳酸氢钠作发酵粉 | D.天然气燃烧 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g )
)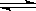 M(g)+N(s),所得实验数据如下表:
M(g)+N(s),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | n(N) | ||
① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
② | 800 | 0.20 | 0.80 | a | a |
③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
下列说法不正确的是:
A.实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L·min)
B.实验②中,该反应的平衡常数K=12.5
C.实验②中,达到平衡时,a大于0.16
D.正反应为放热反应
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
钛被誉为“21世纪金属”,工业冶炼钛的第一步反应为:TiO2+2C+2Cl2 TiCl4+2CO。下列关于该反应的说法正确的是
TiCl4+2CO。下列关于该反应的说法正确的是
A.TiO2是氧化剂
B.四氯化钛是还原产物
C.Cl2发生氧化反应
D.氧化剂与还原剂的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市五县高二上期末化学试卷(解析版) 题型:填空题
电解原理在工业生产中应用广泛。
(1)电解法生产MnO2的方法是以石墨为电极,电解酸化的MnSO4溶液。MnO2在_________极产生,若电解电路中通过2 mol电子,则MnO2的理论产量为_________ g。
(2)工业二氧化硫尾气用Na2SO3吸收后转化为NaHSO3溶液,再用惰性电极电解NaHSO3 溶液,可在生产硫酸的同时再生成 Na2SO3。 原理如图所示
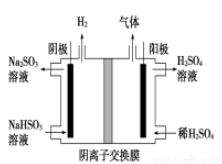
①电解总反应方程式是____________________________。
②阳极区可能放出SO2,分析其产生的原因:__________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
下列热化学方程式正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)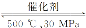 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+ O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,表示稀硫酸与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com