
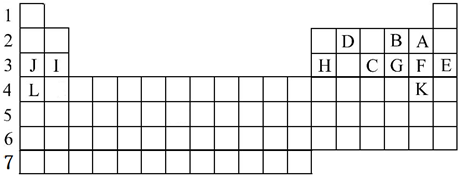
分析 由元素在周期表中位置,可知A为氟、B为氧、D为碳、J为Na、I为Mg、H为Al、C为磷、G为硫、F为Cl、E为Ar、L为钾、K为Br.
(1)稀有气体最外层为稳定结构,化学性质最不活泼;同周期自左而右金属性减弱,同主族自上而下金属性增强;常温下单质为液态的非金属元素是溴;
(2)同周期自左而右原子半径减小;
(3)非金属性越强,氢化物越稳定;
(4)金属性越强,最高价氧化物的水化物的碱性越强.
解答 解:由元素在周期表中位置,可知A为氟、B为氧、D为碳、J为Na、I为Mg、H为Al、C为磷、G为硫、F为Cl、E为Ar、L为钾、K为Br.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;同周期自左而右金属性减弱,同主族自上而下金属性增强,上述元素中K的金属性最强;常温下单质为液态的非金属元素是溴,
故答案为:Ar;K;Br
(2)同周期自左而右原子半径减小,故第二周期中F原子半径最小,
故答案为:F;
(3)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性F>Cl>P,非金属性越强,氢化物越稳定,氢化物中PH3最不稳定,
故答案为:PH3;
(4)同周期自左而右金属性减弱,同主族自上而下金属性增强,故金属性K>Na>Mg,金属性越强,最高价氧化物的水化物的碱性越强,故Mg(OH)2碱性最弱,
故答案为:Mg(OH)2.
点评 本题考查元素周期律和元素周期表的综合应用,侧重对元素周期律的考查,熟练掌握周期表的结构,难度不大,注意基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
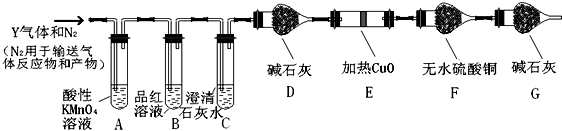 (2)写出产生CO2的化学方程式C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O.
(2)写出产生CO2的化学方程式C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O.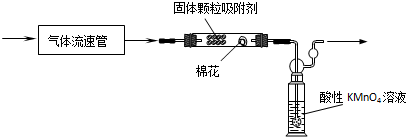
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定新制氯水pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 稀盐酸可除去烧瓶内残留的MnO2 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
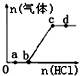 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Ca2+、SO42-、NO3- | |
| B. | b点对应的溶液中:K+、Na+、OH-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol NH5中含有5 mol N-H 键 | |
| B. | NH5的熔沸点高于NH3 | |
| C. | NH5固体投入少量水中,可产生两种气体 | |
| D. | NH5中既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 键线式中的Et代表的基团为-CH3 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 该有机物不同化学环境的氢原子有8种 | |
| D. | 该有机物不可能发生消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com