

���� ��1���ɼ״���������ȼ���ȣ��ɵ��Ȼ�ѧ����ʽ��
��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H1=-725.5kJ/mol��
��H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H2=-285.8kJ/mol��
���ݸ�˹���ɣ��ڡ�3-�ٿɵã�CO2��g��+3H2��g���TCH3OH��l��+H2O��l����
��2��700��ʱ1g$\frac{c��CO��}{c��C{O}_{2}��}$Խ����KԽС��˵����Ӧ���еij̶�С������������Խ�ѱ���ԭ��700��ʱ��KԽС��˵����Ӧ���еij̶�С������������Խ�ѱ���ԭ��
���ݷ���ʽ��д�÷�Ӧ��ƽ�ⳣ������ʽ��700��ʱ1g$\frac{c��CO��}{c��C{O}_{2}��}$��ֵ���㣻
��3������ͼ��֪����3.5��106 Pa��4.0��106Paʱת������ԱȽϴ�������ѹǿ��ת�������࣬����豸Ҫ��ϴ�
����ͼ��֪������80��ʱ���¶ȶԷ�Ӧ����Ӱ���С���ҷ�Ӧ���ȣ������¶�ʱƽ�������ƶ���ת���ʽ��ͣ�
��� �⣺��1���ɼ״���������ȼ���ȣ��ɵ��Ȼ�ѧ����ʽ��
��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H1=-725.5kJ/mol��
��H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H2=-285.8kJ/mol��
���ݸ�˹���ɣ��ڡ�3-�ٿɵã�CO2��g��+3H2��g���TCH3OH��l��+H2O��l����H=-131.9KJ/mol
�ʴ�Ϊ��CO2��g��+3H2��g���TCH3OH��l��+H2O��l����H=-131.9KJ/mol��
��2��700��ʱ1g$\frac{c��CO��}{c��C{O}_{2}��}$Խ����KԽС��˵����Ӧ���еij̶�С������������Խ�ѱ���ԭ����ͼ��֪700��ʱ���������ѱ���ԭ�Ľ�����������Cr2O3����ʱCr2O3��Ӧ1g$\frac{c��CO��}{c��C{O}_{2}��}$=4����$\frac{c��CO��}{c��C{O}_{2}��}$=10-4��
һ����̼��ԭ����������Ӧ�Ļ�ѧ����ʽΪ��3CO��g��+Cr2O3��s��$\frac{\underline{\;����\;}}{\;}$2Cr��s��+3CO2��g������K=$\frac{{c}^{3}��C{O}_{2}��}{{c}^{3}��CO��}$=10-12��
�ʴ�Ϊ��Cr2O3��10-12��
��3���ٴӷ�Ӧѹǿ�Լ״�ת���ʵ�Ӱ�조Ч�ʡ�����ͼ����ת���ʱ仯������3.5��106 Pa��4.0��106Pa��������ѹǿ��ת�������࣬����豸Ҫ��ϴ���ѡ��ѹǿ��3.5��106 Pa��4.0��106Pa��
�ʴ�Ϊ��3.5��106 Pa��4.0��106Pa��
����ͼ��֪���¶��ڸ���80��C�Է�Ӧ����Ӱ�첻��Ӧ�Ƿ��ȷ�Ӧ���¶ȹ��ߣ�ƽ��������У��״�ת���ʻή�ͣ�
�ʴ�Ϊ������80��ʱ���¶ȶԷ�Ӧ����Ӱ���С���ҷ�Ӧ���ȣ������¶�ʱƽ�������ƶ���ת���ʽ��ͣ�
���� ���⿼�黯ѧƽ����㡢��ѧƽ��ͼ��˹����Ӧ�õȣ����ؿ���ѧ����ͼ��ķ���������֪ʶ�������������������Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�1mol���鹲�õ��Ӷ���Ϊ6NA | |
| B�� | 1mol��ȩ����������Cu��OH��2����Һ��Ӧ��ת�Ƶ�����ĿΪ2NA | |
| C�� | ��״���£�1L������ȼ�պ�������̬����ķ�����Ϊ$\frac{8}{22.4}$NA | |
| D�� | 0.1mol�����0.1mol������ȫȼ�����ĵ�O2��������Ϊ0.2 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ��D2O����������������Ϊ8 | B�� | NH3�ĽṹʽΪ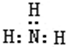 | ||
| C�� | HCl�ĵ���ʽΪ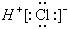 | D�� | ���ȶ��ԣ�H2S��HF |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHCO3 �ĵ��룺NaHCO3?Na++H++CO${\;}_{3}^{2-}$ | |
| B�� | HS-�ĵ��룺HS-+H2O?H3O++S2- | |
| C�� | H3PO4�ĵ��룺H3PO4?3H++PO${\;}_{4}^{3-}$ | |
| D�� | ����״̬��NaHSO4�ĵ��룺NaHSO4�TNa++SO${\;}_{4}^{2-}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | �Լ� | ʪ�����ֽ | ���� | ���� |
| A | Na2SO3��Ũ���� | Ʒ����ֽ | ��ɫ | SO2����Ư���� |
| B | Ũ��ˮ����ʯ�� | ��ɫʯ����ֽ | ��� | ����Ϊ�������� |
| C | ��ˮ | ������ֽ | ���� | ����������� |
| D | Cu��Ũ���� | ����-KI��ֽ | ���� | NO2Ϊ�������� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������й�������Ϊ����������������ijЩ�����Ŀɼ�����ɵ� | |
| B�� | �����������õĵ����ԣ�����Ϊ�ڽ��������й����˽���ԭ�ӵļ۵��ӣ�����糡�����������ɵ��Ӷ����ƶ����γ��˵��������Խ������� | |
| C�� | �����������õĵ����ԣ�����Ϊ���ɵ��������Ⱥӿ����˶����ʣ����ɵ���ͨ����������ӷ�����ײ������������ | |
| D�� | ��������������õ���չ�ԣ�����Ϊ���������е�ԭ�Ӳ���Ի��������ƻ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com