
| 选项 | 叙述I | 叙述II |
| A. | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B. | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验SO42- |
| C. | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D. | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.利用二者溶解度随温度变化不同进行分离;
B.BaSO4难溶于酸,先加入盐酸可排除Ag+或SO32-的影响;
C.氨水溶液呈碱性,可使酚酞变红,为化学性质,形成喷泉,为物理性质;
D.氢氧化钙微溶于水.
解答 解:A.用重结晶法除去硝酸钾中混有的氯化钠,是因为硝酸钾的溶解度随温度的变化而变化很明显,而氯化钠基本不变,当温度降低时,硝酸钾溶解度迅速减小,氯化钠基本不变,所以降低温度时,硝酸钾迅速析出,氯化钠不析出,这并非由于硝酸钾的溶解度大造成的,故A错误;
B.硫酸钡难溶于酸,加入盐酸没有沉淀,可以排除银离子的干扰,加入氯化钡产生沉淀,沉淀为硫酸钡,由此可以检验是否含有SO42-,故B正确;
C.氨气可用于设计喷泉实验是因为氨气极易溶于水,并非氨气能使酚酞变红,故C错误;
D.氢氧化钙微溶于水,加入足量水可以制成澄清石灰水,但是不能制的较高浓度的氢氧化钙溶液,故D错误.
故选B.
点评 本题考查混合物分离提纯以及物质的检验和鉴别,为高频考点,把握物质的性质及混合物分离方法、原理为解答的关键,选项A为解答的易错点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-═3CO2+4H2O | |
| B. | 该电池的总反应是:C3H8+5O2═3CO2+4H2O | |
| C. | 电路中每通过5mol电子,约有5.6L标准状况下的丙烷被完全氧化 | |
| D. | 在熔融电解质中,O2-由负极移向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 向紫色石蕊试液中加入新制氯水,石蕊试液先变红后褪色 | |
| D. | 区别溶液和胶体的最简单的方法是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (3)装置B中试剂的作用是检验SO2是否除尽.
(3)装置B中试剂的作用是检验SO2是否除尽.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
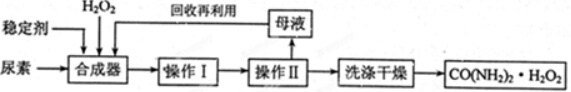
 H2O2+
H2O2+ 6H+=
6H+= Mn2++
Mn2++ O2↑+
O2↑+ 8H2O;
8H2O;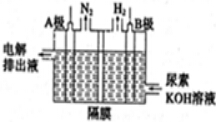
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com