
������������Դ���������й㷺��;��������Ni���������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4��װ����ͼ��ʾ�������ƶϺ�������
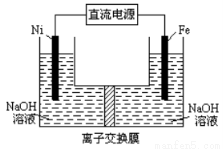
A�����������缫��ӦΪFe��6eһ+4H2O=FeO42��+ 8H+
B��� ʱ���ӵ���������Ϊ��������Ni�缫����Һ��Fe�缫������
ʱ���ӵ���������Ϊ��������Ni�缫����Һ��Fe�缫������
C����ĤΪ�����ӽ���Ĥ����OH�����������ƶ�
D���ʱ������pH���͡�������pH���ߣ���ȥ��Ĥ��Ϻ���ԭ��Һ�Ƚ�pH���ͣ�������ǰ������仯���Բ��ƣ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧKsp�����Ӧ�ã������棩 ���ͣ�ѡ����
����˵����ȷ����
A��KClO3��SO3����ˮ���ܵ��磬��KClO3��SO3Ϊ�����
B��25��ʱ���ô�����Һ�ζ���Ũ��NaOH��Һ��pH��7��V���VNaOH
C����NaAlO2��Һ�еμ�NaHCO3��Һ���г�������������
D��AgCl��ת��ΪAgI������K(AgX)��c(Ag+)? c(X��)����K(AgI)��K(AgCl)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��7 ���ͣ�ʵ����
��ͭ���ǹ�ҵ��ͭ����Ҫԭ�ϣ�����Ҫ�ɷ�ΪCuFeS2������һ����Ȼ��ͭ������SiO2����Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ�ijͬѧ���������ʵ�飺

�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.150g���ڿ��������½������գ�����Cu��Fe3O4��SO2���壬ʵ���ȡd����Һ��1/10������ƿ�У���0.05mol/L������Һ���еζ������ı���Һ20.00mL����ش��������⣺
��1��������Ʒ���õ�����Ϊ ���������ƽ��������ƽ����������Ʒ��ϸ���ٷ�Ӧ����Ŀ���� ��
��2��װ��a��c�����÷ֱ��� �� �����ţ���
a����ȥSO2����
b����ȥ�����е�ˮ����
c��������������
d�������ڹ۲��������
e����ȥ��Ӧ����������
��3��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ���� ��
��4��ͨ�������֪���û�ͭ��Ĵ���Ϊ ��
��5��������ͼװ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ�ĵ��� ������ţ���

��6������ԭװ��d�е���Һ��ΪBa(OH)2����õĻ�ͭ�����Ϊ��1%������ʵ���������ȷ�����ܵ�ԭ����Ҫ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��6 ���ͣ������
ij��֪A��B���������ֶ�����Ԫ����ɵĻ����A��ijԪ�ص���������Ϊ25%��B����ɫ��Ӧ�ʻ�ɫ��C��J��X��ͬ���ڵ�Ԫ�صļ��⻯�XΪ��ɫҺ�壬C��JΪ���壬D��һ�ֲ�����ˮ�İ�ɫ���塣��Ӧ���ɵ�ˮ������ȥ������������ͼ��ʾ�Ĺ�ϵ��

��1��д����ѧʽ��A_________ E___________ L___________��
��2���ڷ�Ӧ�٢ڢۢܢ�������������ԭ��Ӧ����_____________��
��3����Ӧ�ۻ�ѧ����ʽΪ��______________________________��
��4��д���������ӷ���ʽ����Ӧ�� ��G��Һ��M��Һ�ķ�Ӧ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��6 ���ͣ�ѡ����
ɽ������Ӧ�ù㷺��ʳƷ����������ṹ��ͼ�����й���ɽ�����˵���������

A����ʽΪC6H8O2
B 1mol������������3mol Br2�����ӳɷ�Ӧ
C��ʹ����KMnO4��Һ��ɫ
D���봼����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��6 ���ͣ�ѡ����
������Ԫ��X��Y��Z����ԭ�Ӻ����������Ϊ32�������γɳ��������嵥�ʡ�Xԭ�����������������ڲ��������3����Y����̬�⻯����������������Ӧ��ˮ����ǡ�÷�Ӧ�IJ���ֻ��һ��A��A��ˮ��Һ�����ԡ�����˵����ȷ����
A��ԭ�Ӱ뾶�� Z��X ��Y��������
B��XԪ���γɵĵ�����Ħ������һ����32g��moL��1��
C������A�мȺ����Ӽ��ֺ����ۼ�����������
D��YX2��ZX2���ж�Ӧ�ĺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��5 ���ͣ������
ʵ������ȡ���ᶡ����ʵ��װ����������ͼ��ʾ����װ�ù�ѡ�á����й����ʵ���������

���±���
| ���� | 1-���� | ���ᶡ�� |
�۵�(��) | 16.6 | ��89.5 | ��73.5 |
�е�(��) | 117.9 | 117 | 126.3 |
�ܶ�(g/cm3) | 1.05 | 0.81 | 0.88 |
ˮ���� | ���� | ����(9g/100gˮ) | �� |
��1����ȡ���ᶡ����װ��Ӧѡ��_______(��ס����ҡ�)����ѡ��һ��װ�õ������� ��
��2����ʵ���������г������������ᶡ���⣬���������ɵ��л��������У�д���ṹ��ʽ���� �� ��
��3��������Ӧ��һ�����淴Ӧ��Ϊ���1-������ �����ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
�����ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
��4�����Ʊ����ᶡ�����õĻ�����з��롢�ᴿ���ᶡ��ʱ����Ҫ�����ಽ����������ͼʾ�IJ����У��϶���Ҫ�Ļ�ѧ������___________��ѡ��𰸱�ţ���
��5���л���ķ�������У�������Ҫʹ�÷�Һ©����������ʹ�÷�Һ©��ǰ���� ��ijͬѧ�ڽ��з�Һ����ʱ��������Һ�����������������ԭ�����Һ©�����������⣬������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��4 ���ͣ������
��֪A��B��C��D��E����Ԫ�����ڱ��е�ǰ������Ԫ�أ�����ԭ�������Ĵ�С��ϵΪA<C<B<D<E����֪Aԭ�ӵ�p���Ϊ����������γɵļ��⻯��ķе���ͬ����ǽ���Ԫ�ص��⻯������ߵġ�Dԭ�ӵõ�һ�����Ӻ���3p�����ȫ������B�����ӱ�Dԭ���γɵ�������һ�����Ӳ㡣C��B���γ�BC�͵����ӻ����E��ԭ������Ϊ29��
��ش��������⣺
(1) Ԫ��A���⻯����Aԭ�ӵ��ӻ�������________��B��C��D�ĵ縺����С�����˳��Ϊ______(������Ӧ��Ԫ�ط��ű�ʾ)��C����̬�⻯��������ˮ��ԭ����____________________��
(2)Eԭ�ӵĻ�̬�����Ų�ʽΪ________��Ԫ��E�ĵ��ʾ����ڲ�ͬ�¶��¿������ֶѻ���ʽ�������ֱ���ͼa��b��ʾ���������������ѻ��ľ��������������ѻ��ľ�����ʵ�ʺ��е�Eԭ�ӵĸ���֮��Ϊ____________��

(3)ʵ��֤����KCl��MgO��CaO��TiN��4�־���Ľṹ��NaCl����ṹ����(��ͼ��ʾ)������3�����Ӿ���ľ������������±���
���Ӿ��� | NaCl | KCl | CaO |
������/kJ��mol��1 | 786 | 715 | 3401 |
���4�����Ӿ���(������NaCl)�۵�Ӹߵ��͵�˳���ǣ�________��
(4)���������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�á�������������V2O5��CrO2�У��ʺ���¼�����ŷ�ԭ�ϵ���________��
(5)����ЧӦ����ѧ����Ʒ�Ӧ��CO2��4H2����CH4��2H2O�Լ�С������CO2������1 mol CH4���ɣ�����________mol �Ҽ���________mol �м����ѡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��2 ���ͣ������
̼��̼�Ļ�����㷺�Ĵ� �������ǵ������С�
�������ǵ������С�
��1���������з�Ӧ�������仯ʾ��ͼ��2C(s)+O2(g) =2CO(g) ��H= ��
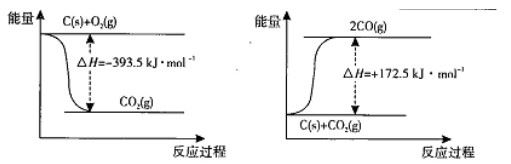

��2�������Ϊ2L���ܱ������У�����1 mol CO2��3mol H2��һ��
�����·�����Ӧ��
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H
CH3OH(g)+H2O(g) ��H
���CO2(g)��CH3OH(g)�����ʵ�����ʱ��仯����������ͼ��ʾ:
�ٴӷ�Ӧ��ʼ��ƽ�⣬H2O��ƽ����Ӧ����v(H2O)= ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����� �����ţ���
A�������¶� B����CH3OH��g����ʱҺ���Ƴ�
C��ѡ���Ч���� D���ٳ���l mol CO2��4 mol H2
��3�� CO2����ˮ����̼�ᡣ��֪�������ݣ�
������� | H2CO3 | NH3��H2O |
����ƽ�ⳣ���� 25�棩 | Ka1= Ka2= 5��61�� 10һ11 | Kb = 1��77�� 10һ5 |
���г�����1 mol��L��1��( NH4)2CO3��Һ����֪��NH4+ˮ���ƽ�ⳣ��Kh=Kw/Kb��
CO32-��һ��ˮ���ƽ�ⳣ��Kh=Kw/Ka2��
���жϸ���Һ�� ����ᡱ�����С��� ������ԣ�д������Һ��CO32-
������һ��ˮ������ӷ���ʽ ��
����������֮��Ĺ�ϵʽ��������ȷ���� ��
A��c(NH4+)��c(HCO3-)�� c(CO32-)��(NH4+)
B��c(NH4+)+c(H+)= c(HCO3-)+c(OH-)+ c(CO32-)
C. c(CO32-)+ c(HCO3-)+c(H2CO3)=1mol/L
D. c(NH4+)+ c(NH3.H2O)=2 c(CO32-)+ 2c(HCO3-) +2c(H2CO3)
��4���ݱ�������ѧ����ʵ���������Ƴ���ȼ�ϵ�صķ�Ӧ�����У�������
��缫������CO��O2Ϊԭ�����ɵ�ء�ԭ����ͼ��ʾ��ͨ��CO�Ĺܿ��� ���c����d������д���õ缫�ĵ缫��Ӧʽ�� ��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com