
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
分析 含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴,
(1)亚硫酸钠具有还原性,能还原氧化性离子;
(2)根据反应3Cl2+6NaOH=NaClO3+5NaCl+3H2O;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑的关系进行计算,具体见解答;
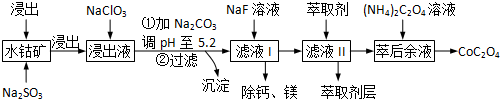
(3)根据图知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(4)当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=$\frac{\frac{Ksp(Mg{F}_{2})}{{c}^{2}(F-)}}{\frac{Ksp(Ca{F}_{2})}{{c}^{2}(F-)}}$=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$,带入数值即可计算;
(5)用高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色),且半分钟内不变色时,达到滴定终点;根据n=cV计算反应中草酸的物质的量,根据方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O计算V中高锰酸钾的物质的量,再计算原样品中的物质的量,进而计算纯度.
解答 解:含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴,
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,
故答案为:Fe3+、Co3+;
(2)根据反应3Cl2+6NaOH=NaClO3+5NaCl+3H2O
3mol 106.5g
0.3mol 10.65g
2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑
1mol 22.4L
0.3mol 22.4×0.3=6.72L
故答案为:6.72L;
(3)由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:B;
(4)当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=$\frac{\frac{Ksp(Mg{F}_{2})}{{c}^{2}(F-)}}{\frac{Ksp(Ca{F}_{2})}{{c}^{2}(F-)}}$=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$=$\frac{7.35×1{0}^{-11}}{1.05×1{0}^{-10}}$=0.7,
故答案为:0.7;
(5)根据n=cV计算反应中草酸的物质的量,设样品中含CoC2O4质量为x,根据方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,草酸根守恒可得:
5CoC2O4-5(NH4)2C2O4-5H2C2O4-2MnO4-
146.93g 2mol
x CV×10-3mol
样品纯度=$\frac{x}{m}$×100%,带入数据可得纯度为$\frac{36.75cv}{m}$%;
故答案为:$\frac{36.75cv}{m}$%.
点评 本题考查物质分离和提纯,为高频考点,涉及溶度积常数计算、沉淀与pH的关系、盐类水解、氧化还原反应等知识点,明确实验原理是解本题关键,知道涉及的操作方法及发生的反应,难点是溶度积常数计算,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、I-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛、乙酸 | B. | 乙醇、乙二醇 | C. | 甲烷、丙炔 | D. | 苯、乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合气为体积比为1:2的乙烯和乙炔 | |
| B. | 原混合气为体积比为1:1的丙烯和丙炔 | |
| C. | 原混合气为任意体积比的乙烯和乙炔 | |
| D. | 原混合气为体积比为1:2的乙烯和丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
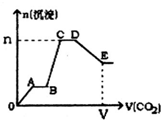
| A. | A~B段和C~D段发生的反应相同 | |
| B. | B~C段反应的离子方程式是 A1O2-+2H2O+CO2═Al(OH)3↓+HCO3- | |
| C. | V=134.4L,n=3mol | |
| D. | D点所得溶液中离子浓度关系为c(K+)>c(CO${\;}_{3}^{2-}$)>c(OH-)>c(HCO${\;}_{3}^{-}$)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:| 化学键 | O-H | N-N | N-H | O=O | N═N |
| 键能/KJ•mol-1 | 467 | 160 | 391 | 498 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苯环上的一氯代物种数相同 | |
| B. | 分子中共面的碳原子数一定相同 | |
| C. | 1 mol甲与浓溴水反应最多能消耗4 mol Br2 | |
| D. | 甲、乙可用红外光谱区分,但不能用核磁共振氢谱区分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
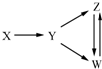 一定条件下,下列各组物质能一步实现图所示转化关系的是( )
一定条件下,下列各组物质能一步实现图所示转化关系的是( )| 选项 | X | Y | Z | W |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | Fe3O4 | Fe | FeCl2 | FeCl3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | CH3CH2Br | CH2═CH2 | C2H5OH | CH2BrCH2Br |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com