
【题目】(15分)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
(1)Co基态原子核外电子排布式为 . 元素Mn与O中,第一电离能较大的是 , 基态原子核外未成对电子数较多的是 .
(2)CO2和CH3OH分子中C原子的杂化形式分别为和 .
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 , 原因是 .
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在 .
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2﹣)为nm.MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为nm.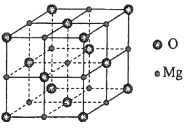
【答案】
(1)1s22s22p63s23p63d74s2或[Ar]3d74s2;O;Mn
(2)sp;sp3
(3)H2O>CH3OH>CO2>H2;常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高
(4)π键、离子键
(5)![]() ;
;![]()
【解析】解:(1)Co是27号元素,位于元素周期表第4周期第VIII族,其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2 . 元素Mn与O中,由于O元素是非金属性而Mn是过渡元素,所以第一电离能较大的是O,O基态原子价电子为2s22p4 , 所以其核外未成对电子数是2,而Mn基态原子价电子排布为3d54s2 , 所以其核外未成对电子数是5,因此核外未成对电子数较多的是Mn,
所以答案是:1s22s22p63s23p63d74s2或[Ar]3d74s2;O;Mn;(2)CO2和CH3OH的中心原子C原子的价层电子对数分别为2和4,所以CO2和CH3OH分子中C原子的杂化形式分别为sp和sp3 ,
所以答案是:sp;sp3;(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为H2O>CH3OH>CO2>H2 , 原因是常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高,
所以答案是:H2O>CH3OH>CO2>H2;常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高;(4)硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中N原子与3个氧原子形成3个σ键,硝酸根中有一个氮氧双键,所以还存在π键,
所以答案是:π键、离子键;(5)因为O2﹣是面心立方最密堆积方式,面对角线是O2﹣半径的4倍,即4r= ![]() a,解得r=
a,解得r= ![]() nm;MnO也属于NaCl型结构,根据晶胞的结构,Mn2+构成的是体心立方堆积,体对角线是Mn2+半径的4倍,面上相邻的两个Mn2+距离是此晶胞的一半,因此有
nm;MnO也属于NaCl型结构,根据晶胞的结构,Mn2+构成的是体心立方堆积,体对角线是Mn2+半径的4倍,面上相邻的两个Mn2+距离是此晶胞的一半,因此有 ![]() nm,
nm,
所以答案是: ![]() ;
; ![]() .
.
【考点精析】本题主要考查了氢键的存在对物质性质的影响的相关知识点,需要掌握氢键主要存在于HF、H2O、NH3、CH3CH2OH分子间;故HF、H2O、NH3的沸点分别与同族氢化物沸点相比反常的高才能正确解答此题.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】实验室用铁片和稀硫酸制备H2。下列说法不正确的是
A. 升高温度能加快反应速率 B. 用铁粉代替铁片能加快反应速率
C. 滴入数滴CuSO4溶液能加快反应速率 D. 增加H2SO4用量能加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应就能实现的是( )
A.Al﹣Al2O3﹣Al(OH)3﹣NaAlO2
B.S﹣SO3﹣H2SO4﹣MgSO4
C.Mg﹣MgCl2﹣Mg(OH)2﹣MgO
D.Si﹣SiO2﹣H2SiO3﹣Na2 SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质与应用不正确的是
A. 液氯可以储存在钢瓶中
B. 二氧化硫可用于漂白纸浆
C. 碳酸钠是焙制糕点所用的发酵粉的主要成分之一
D. 硅晶体是半导体材料,广泛应用于电子工业的各个领域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:mA(g)+nB(g)pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的 ![]() ,当达到新平衡时,C的浓度为原来的1.9倍.下列说法中正确的是( )
,当达到新平衡时,C的浓度为原来的1.9倍.下列说法中正确的是( )
A.m+n>p
B.A的转化率降低
C.平衡向正反应方向移动
D.C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识中,不正确的是( )
A.白炽灯工作时,电能转化为化学能
B.绿色植物进行光合作用时,太阳能转化为化学能
C.电解水生成氢气和氧气,电能转化为化学能
D.煤燃烧时化学能主要转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性; F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸;C和D是两种常见的强酸.请回答下列问题: 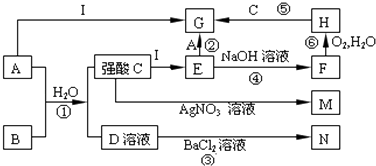
(1)写①的化学方程式
(2)写反应②的离子方程式 ﹣
(3)写出将A通入石灰乳的化学方程式
(4)在①②③④⑤⑥中,属于氧化还原反应的有:(填编号)
(5)F很不稳定,露置在空气中容易被氧化为H,该反应的化学方程式为 保存 E溶液时应加入少量的
(6)检验G溶液中阳离子的方法:(写出加入试剂的化学式和现象)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2﹣和HCO﹣3)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO32﹣﹣52e﹣═34CO2+10H2O. 试回答下列问题:
(1)该燃料电池中发生氧化反应的物质是 .
(2)该燃料电池的化学反应方程式为;
(3)某学生想用该燃料电池电解饱和食盐水,写出反应的离子方程式 .
(4)当电路中通过0.26NA的电子时,消耗的氧气的体积(标况)为;此时电解饱和食盐水生成的氯气的物质的量是;若此时溶液体积为200ml,则生成的NaOH的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合已学知识,并根据下列一组物质的特点回答相关问题. 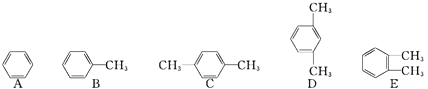
(1)邻二甲苯的结构简式为(填编号).
(2)A、B、C之间的关系为(填序号).
A.同位素
B.同系物
C.同分异构体
D.同素异形体
(3)请设计一个简单实验来检验A与D,简述实验操作过程: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com