
| 3-n |
| 2 |
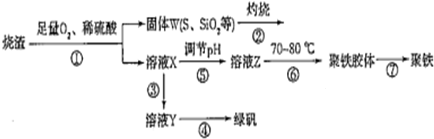
| ||
| 3-n |
| 2 |
| ||
| n |
| 2 |
| ||
| n |
| 2 |
| n |
| 2 |
| n |
| 2 |
| n |
| 2 |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、摩尔可以把物质的宏观数量与微观粒子的数量联系起来 |
| C、摩尔是物质的量的单位,简称摩,符号为mol |
| D、国际上规定,0.012kg碳原子所含有的碳原子数目为1摩尔 |
查看答案和解析>>
科目:高中化学 来源: 题型:

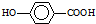 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 的同分异构体很多,其中符合下列条件有
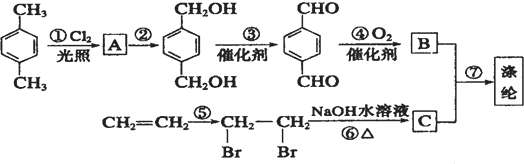
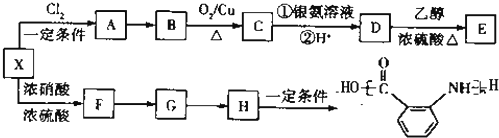
的同分异构体很多,其中符合下列条件有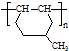 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图: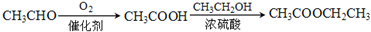
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H6与氯气发生取代反应、C2H4与HCl发生加成反应均可得到纯净的C2H5Cl |
| B、将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 |
| C、乙烯结构中含有碳碳双键,苯中不含有碳碳双键,但两者均可以发生加成反应 |
| D、苯使酸性KMn04溶液、溴水都褪色,发生的都是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A、△H>0 a+b>c |
| B、△H<0 a+b<c |
| C、△H<0 a+b>c |
| D、△H>0 a+b<c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com