
短周期元素A、B、C的原子序数之和为37,A、B在同一周期,A+、C-具有相同的核外电子层结构。下列推测不正确的是( )
A. 同周期元素中C的氢化物稳定性最强
B. 同周期元素中A的金属性最强
C. 原子半径:A>B,离子半径:A+>C-
D. A、B、C的简单离子中,会破坏水的电离平衡的是C
科目:高中化学 来源:2017届内蒙古高三上9月月考化学卷(解析版) 题型:选择题
下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①少量Ca( OH)2投入过量NaHCO3溶液中
OH)2投入过量NaHCO3溶液中
②过量NaOH溶液和明矾溶液混合
③金属钠投入到FeCl2中
④向NaAlO2溶液中通入过量CO2[
⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④⑤ C.只有②③ D.只有③④
D.只有③④
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次段考化学试卷(解析版) 题型:选择题
化学在工农业生产和日常生活中都有着重要的应用。下列说法错误的是( )
A.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
B.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
C.锅炉水垢中含有 的CaSO4,可先用Na2CO3溶液处理,后用酸除去
的CaSO4,可先用Na2CO3溶液处理,后用酸除去
D.防止酸雨发生的重要措施之一是使用清洁能源
查看答案和解析>>
科目:高中化学 来源:2017届江苏省无锡市三校联合体高三上第一次月考化学试卷(解析版) 题型:选择题
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是

A.灼烧 B.过滤 C.分液 D.蒸馏
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:填空题
锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
⑴Ga的原子结构示意图为 ___________________。
⑵GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式 。
⑶下列有关镓和镓的化合物的说法正确的是____ 。
A.常温下,Ga可与水剧烈反应放出氢气
B.一定条件下,Ga可溶于盐酸和氢氧化钠
C.一定条件下,Ga2O3可与NaOH反应生成盐
D.Ga2O3可由Ga(OH)3受热分解得到
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
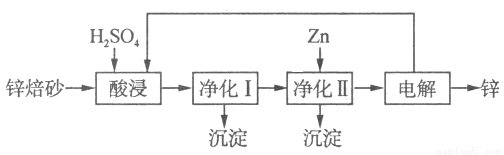
已知:Fe的活泼性强于Ni
⑷ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为 。
⑸净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
⑹净化II中加入Zn的目的是___________________。
⑺常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3] = 8.0 × 10-38;lg5 = 0.7
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列实验能达到预期目的的是( )
编号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸分别测定浓度为18mol/L和0.1 mol·L—1H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
C | 向10mL 0.2 mol·L—1 NaOH溶液中滴入2滴0.1 mol·L—1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol·L—1FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的 Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
D | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
查看答案和解析>>
科目:高中化学 来源:2017届四川省校高三上学期第二次月考化学试卷(解析版) 题型:填空题
【化学-选修3:物质结构与性质】
A、B、C、D、E五种元素的原子序数依次增大。A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍;D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态。试回答下列问题:
(1)基态D原子核外电子的排布式为___________________。
(2)B、C、D三种元素的电负性由大到小的顺序是_______________________(填元素符号)。
(3)E(NH3)2+ 4离子的颜色是___________;含有化学键类型是_________________;离子中N原子杂化轨道类型是_________________。
(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。晶体乙中,E的配位数为_________;在一定条件下,甲和C2A4反应生成乙,同时生成在常温下分别为气体和液体的另外两种常见无污染物质。该化学反应方程式为___________________________。

(5)若甲的密度为ρ g/cm3,NA表示阿伏加德罗常数,则甲晶胞的边长可表示为_________cm。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省实验班高三上第一次质检化学试卷(解析版) 题型:选择题
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(如图甲)在煤矿巷道中的甲烷浓度达到一定值时,其传感器就可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是

A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为CH4+4O2--8e- CO2+2H2O
CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol,
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)=3N2(g) +4H2O(g) ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3 kJ/mol
C.N2H4(g)+ N2O4(g)=
N2O4(g)= N2(g)+2H2O(g) ΔH=-1076.7 kJ/mol
N2(g)+2H2O(g) ΔH=-1076.7 kJ/mol
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com