
【题目】铅氧化还原液流电池是一种新型储能电池。该电池以酸性甲基磺酸铅溶液为电解液,简化的工作原理如图所示,下列说法正确的是
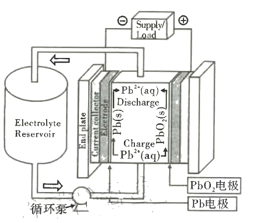
A.放电时,H+经过循环泵向Pb电极移动
B.放电时,负极反应式为Pb-2e- +SO42- = PbSO4
C.充电时,电解液中H+、Pb2+的物质的量浓度均减小
D.充电时,阳极反应式为Pb2+ +2H2O-2e- = PbO2 +4H+
【答案】D
【解析】
铅氧化还原液流电池工作时,放电时Pb为负极,电极反应为:Pb-2e-=Pb2+,逆反应则为充电时的阴极反应;PbO2为正极,反应式为PbO2+4H++2e-=Pb2++2H2O,H+经过循环泵向正极PbO2电极移动,逆反应则为充电时的阳极反应;据图可知该过程中没有沉淀产生。
A. 放电时该装置为原电池,原电池中阳离子流向正极,即向PbO2电极移动,故A错误;
B. 放电时,负极反应为Pb-2e-=Pb2+,据图可知不生成沉淀,且电解质溶液不是硫酸,故B错误;
C. 充电时,阳极反应时为:Pb2++2H2O-2e- = PbO2 +4H+,可知氢离子浓度增大,铅离子浓度减小,故C错误;
D. 根据分析可知,充电时Pb2+被氧化成PbO2,电极方程式为Pb2++2H2O-2e- = PbO2 +4H+,故D正确;
故答案为D。


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学知识在生活中应用广泛。
(1)糖类、油脂和蛋白质是动物性和植物性食物中的基本营养物质。
①下列有关说法中,正确的是________________;
A.棉、麻、木材、蚕丝的主要成分都是纤维素
B.油脂是产生能量最高的营养物质
C.蛋白质在人体内发生水解最终生成氨基酸
D.糖类都是有甜味的物质
E.淀粉、纤维素、蛋白质都是天然高分子化合物
F.硫酸铵或乙酸铅溶液加入到蛋白质溶液中,蛋白质都能从溶液中析出
②葡萄糖是最重要、最简单的单糖,除了是一种营养物质,还能用在制镜等工业上。写出葡萄糖发生银镜反应的化学方程式:_____________________________________________。
(2)苹果酸常用作汽水、糖果的添加剂,其结构简式为![]() ,该分子中官能团的名称为________________,可以和醇类物质发生__________反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为_________________。
,该分子中官能团的名称为________________,可以和醇类物质发生__________反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为_________________。
(3)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)

①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是_____________;
②生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的有(填序号)___________________;
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
③现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。

试剂a是______,分离方法①是_______;分离方法②是________,试剂b是________;
④写出C → D 反应的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O+H+ Ka1、HC2O
HC2O+H+ Ka1、HC2O![]() C2O
C2O![]() +H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O
+H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O![]() 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )

A. Ka1=10-1.2
B. pH=2.7时溶液中:![]() =1000
=1000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜离子是人体内多种酶的辅因子,某化合物与Cu+结合形成如图所示的离子。下列有关该离子说法正确的是( )
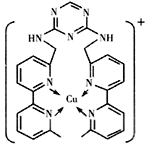
A. 该离子中碳原子的杂化方式为sp2
B. 该离子中氮原子的杂化方式为sp2
C. 该离子中只有共价键(含配位键),没有离子键
D. H、N、Cu三种元素的电负性顺序为:Cu>H>N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒(V)及其化合物有着广泛的用途。请回答以下问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是_____,请写出溶液中VO3-转化为V2O74-的离子方程式:________________________。
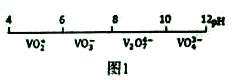
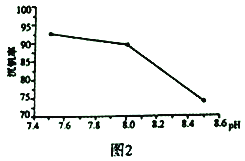
(2)“弱碱性铵盐沉钒法”原理是在含有钒元素的溶液中加入铵盐后形成NH4VO3沉淀,图2是在工业生产中不同pH环境下沉钒率的测定值。实际工业生产中常选择pH=7.5为沉钒的最佳条件,当pH超过8.0时沉钒率降低,其原因是溶液中VO3-转化为V2O74-、____________________________________。(请另写出一点原因)
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g) ![]() 2SO3(g) △H=p的催化剂,其催化原理如图3所示。
2SO3(g) △H=p的催化剂,其催化原理如图3所示。
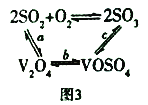
①过程a和过程b的化学方程式为:V2O5(s)+SO2(g)=V2O4(s)+SO3(g) △H = q;V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) △H = r 请写出过程c的热化学方程式:_________________。
②t2℃下,反应:2SO3(g) ![]() 2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。

t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
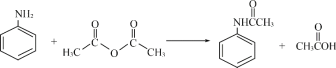
【题目】酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
密度(g/mL) | 相对分子质量 | 颜色、状态 | 溶解性 | |
苯胺 | 1.04 | 93 | 无色油状液体 | 微溶于水, 易溶于乙醇、乙醚 |
乙酸酐 | 1.08 | 102 | 无色透明液体 | 遇水缓慢反应生成乙酸 |
乙酰苯胺 | 135 | 无色片状晶体, 熔点 114℃ | 不溶于冷水,可溶于热 水、乙醇、乙醚 |
实验步骤
①取5.00mL苯胺,倒入 100mL锥形瓶中,加入20mL水,在旋摇下分批加入 6.00mL 乙酸酐,搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至 150mL 烧杯中,加入适量水配制成 80℃的饱和溶液,再加入过量 20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸 3~5min,趁热过滤,冷却结晶,抽滤、洗涤、晾干得乙酰苯胺纯品。
请回答:
(1)苯胺与冰醋酸反应制备乙酰苯胺的化学反应方程式______________________。
(2)反应温度过高会导致苯胺挥发,下列操作可控制反应温度,防止反应温度升高过快的是____________。
A.反应快结束时的充分搅拌 B.旋摇下分批加入 6.0mL 乙酸酐
C.玻璃棒将块状物研碎 D.加 20mL 水
(3)在步骤②中对粗产品进行洗涤可能需要用到以下操作:
a.加入洗涤剂至浸没固体;
b.洗涤剂缓慢通过;
c.洗涤剂快速通过;
d.关小水龙头;
e.开大水龙头;
f.重复 2~3 次。
请选出正确的操作并排序_____。(操作可重复使用)
(4)加入过量 20%的水的目的是_____。
(5)下列关于步骤③说法不正确的是__________________________。
A.活性炭吸附有色物质,可以提高产率
B.冷却时,冰水浴冷却比室温冷却更易得到大颗粒晶体便于抽滤
C.抽滤用如图装置,为防止倒吸,结束时可先关闭抽气泵,后打开活塞 a

D.洗涤完成后应将布氏漏斗从吸滤瓶上取下,左手握布氏漏斗,倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的表面皿上,揭去滤纸,再对固体做晾干处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源。海水综合利用的流程图如下。
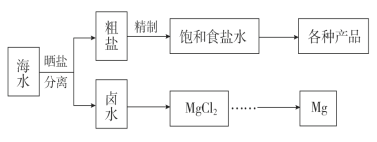
(1)用NaCl作原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是______。
②写出产物氯气制备“84”消毒液的离子方程式:______。
③NaCl也是侯氏制碱法的重要反应物之一,写出侯氏制碱法过程中涉及到的两个主要方程式:__________ , __________。
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O―→NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为________mol。
(3)海水提镁的一段工艺流程如下图:
卤水![]()
![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2![]() Mg
Mg
①采用石墨电极电解熔融的氯化镁,发生反应的化学方程式_________;
②电解时,若有少量水存在,则不能得到镁单质,写出有关反应的化学方程式__________。
(4)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
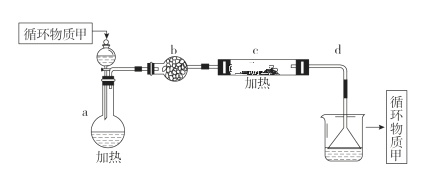
①上图中,装置a由________、________、双孔塞和导管组成。
②循环物质甲的名称是________。
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
(1)Fe2+基态核外电子排布式为 ________。
(2)PO43-的空间构型为 ________ (用文字描述)。
(3)![]() 中
中![]() 的配位数为6,该配合物中的配位原子为 _____。
的配位数为6,该配合物中的配位原子为 _____。
(4)碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为_____,1mol碳酸二乙酯(DEC)中含有σ键的数目为_____。
![]()
(5)氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为_______。
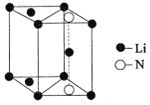
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com