
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
| B | NaCl | KNO3 | 冷却热饱和溶液,过滤 |
| C | Cu | Zn | 加入足量稀盐酸,充分反应后过滤,洗涤,干燥 |
| D | FeCl2溶液 | CuCl2 | 加入足量铁粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀铜,表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 铁丝与浓硫酸在常温下钝化 | |
| D. | 在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氦气的摩尔质量是8g•mol-1 | |
| C. | 1molH2SO4中含1molH2 | |
| D. | 1molH2O的质量是18g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
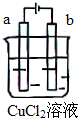
| A. | 电极a表面呈红色 | |
| B. | 电极b表面有气泡生成 | |
| C. | 电子由电源的负极沿导线流向电极b | |
| D. | 该装置能量转化形式为化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
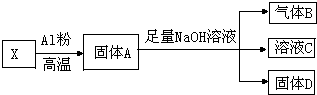 某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)
某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
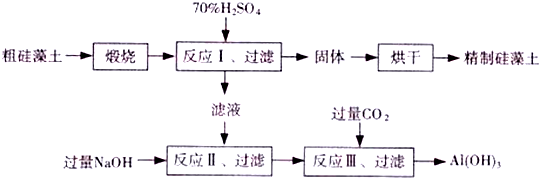
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
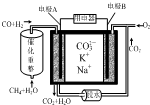
| A. | 电极A为正极,发生了还原反应 | |
| B. | 电极A上CO参与的电极反应为:CO+O2--2e-═CO2 | |
| C. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| D. | 电池工作时,K+向电极A移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com