
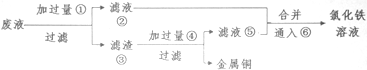
分析 (1)检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;
(2)用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2;
(3)腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故①为Fe,经过滤所得滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量盐酸可以将铜分离,得到的滤液为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化为三价铁,以此解答该题.
解答 解:(1)检验溶液中Fe3+存在的试剂是KSCN溶液,发生Fe3++3SCN-=Fe(SCN)3,则证明Fe3+存在的现象是溶液变成红色,故答案为:KSCN溶液;溶液变成红色;
(2)铜与氯化铁反应生成氯化铁、氯化亚铁,反应离子方程式为:2Fe3++Cu=Cu2++2Fe2+,
故答案为:2Fe3++Cu=Cu2++2Fe2+;
(3)①腐蚀废液中含有氯化铜、氯化亚铁即氯化铁,加入过量的铁可以和氯化铁反应生成氯化亚铁,和氯化铜反应生成金属铜和氯化亚铁,故滤液②是氯化亚铁,滤渣③是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入足量的盐酸可以将铜分离,得到的滤液⑤是氯化亚铁,氯气具有氧化性,能将亚铁离子氧化为三价铁,故⑥是氯气,
故答案为:Fe;FeCl2;
②反应①为Fe+Cu2+═Cu+Fe2+,反应④为Fe+2H+=Fe2++H2↑,反应⑥为2Fe2++Cl2═2Fe3++2Cl-,
故答案为:Fe+Cu2+═Cu+Fe2+、Fe+2H+=Fe2++H2↑、2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查化学工艺流程、原电池等,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,把握发生的反应及现象、离子检验方法为解答的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Cl-、OH- | B. | Na+、CO32-、OH- | C. | Fe2+、H+、CO32- | D. | Fe3+、K+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:
对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH2=CH3 | B. | CH2=CH-CH2OH | C. | CH3=CH-COOH | D. | CH2=CH-COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 石灰石上滴加稀盐酸:CaCO3+2H+═Ca2++H2CO3 | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: | |
| B. | 乙酸的结构示意图:C2H4O2 | |
| C. | 硫酸的电离方程式:H2SO4═H2++SO42- | |
| D. | 氯化钠的电子式: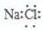 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电解法精炼铜时,粗铜作阴极、精铜作阳极 | |
| B. | 在镀件上电镀铜时,用金属铜作阳极 | |
| C. | 在电解池中,铜作电极时,溶液中的阴离子在铜极上失电子 | |
| D. | 电解饱和食盐水制稀硫酸制Cl2、H2时,可用金属铜作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com