
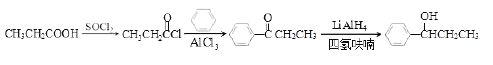
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:

已知:R-CHO+(CH3CO)2O![]() R-CH=CHCOOH+CH3COOH
R-CH=CHCOOH+CH3COOH
(1)A的分子式为_________,C中的官能团名称为_____________。
(2)D分子中最多有________________个原子共平面。
(3)E生成F的反应类型为________________,G的结构简式为________________。
(4)由H生成I的化学方程式为:______________。
(5)符合下列条件的B的同分异构体有多种,其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是(写出其中一种的结构简式) ________________。
①属于芳香化合物;②能发生银镜反应
(6)己知RCOOH![]() RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备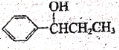 的合成路线。
的合成路线。
【答案】C7H8 羟基 17 消去反应 ![]()
 或
或 ;
; 
【解析】
A为芳香烃,由A到B可推测A可能为甲苯,A得到B是在甲基对位上引入![]() ,由A到G应为氧化过程,G的分子式为C7H6O,进一步可判断G为
,由A到G应为氧化过程,G的分子式为C7H6O,进一步可判断G为![]() ,是由
,是由![]() 被氧化得到的。C中含有-OH,D为C分子内脱水得到的
被氧化得到的。C中含有-OH,D为C分子内脱水得到的 ,E为
,E为 ,在KOH醇溶液作用下可发生消去反应生成F,由已知反应可知,G在一定条件下生成H,H在浓硫酸加热发生酯化反应生成I可逆推知,H为
,在KOH醇溶液作用下可发生消去反应生成F,由已知反应可知,G在一定条件下生成H,H在浓硫酸加热发生酯化反应生成I可逆推知,H为![]() 。
。
(1)由A到B可推测A可能为甲苯(C7H8),A得到B是在甲基对位上引入![]() ,由A到G为氧化过程,G的分子式为C7H6O,进一步可判断G为
,由A到G为氧化过程,G的分子式为C7H6O,进一步可判断G为![]() ,应该是由
,应该是由![]() 被氧化得到的,C中含有的官能团为:-OH;
被氧化得到的,C中含有的官能团为:-OH;
(2)D为C分子内脱水得到的![]() ,由于苯环上的C原子,及与这些C原子直接相连的原子都在一个平面上,与C=C直接相连的原子也在同一平面上,这样通过单键旋转,这两个平面可共面,由于-CH3中C原子与相连的基团呈四面体结构,其中一个H原子可与上述平面共面,D分子式为C9H10,除2个H原子外,其余原子都可能共面,可共面的原子为17个;
,由于苯环上的C原子,及与这些C原子直接相连的原子都在一个平面上,与C=C直接相连的原子也在同一平面上,这样通过单键旋转,这两个平面可共面,由于-CH3中C原子与相连的基团呈四面体结构,其中一个H原子可与上述平面共面,D分子式为C9H10,除2个H原子外,其余原子都可能共面,可共面的原子为17个;
(3)E为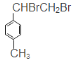 ,在KOH醇溶液作用下可发生消去反应生成F,由上述知G为
,在KOH醇溶液作用下可发生消去反应生成F,由上述知G为![]() ;
;
(4)H为![]() ,变为I发生的是酯化反应,其化学方程式为:
,变为I发生的是酯化反应,其化学方程式为: ;
;
(5)①属于芳香化合物,有苯环,②能发生银镜反应,有醛基,若苯环上有一个取代基,有两种基团:-CH2CH2CHO、-CH(CH3)CHO,因有2种异构体,若有两个取代基,可以是-CH3、-CH2CHO 组合,也可以是-CH2CH3、-CHO组合,分别有邻、间、对三种相对位置,有6种异构体。当苯环上有三个取代基,即2个-CH3和1个-CHO时,其有6种异构体,可由定二移一法确定,如图示: 、
、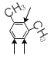 、
、![]() ,箭头为-CHO的可能位置,所以有满足条件的异构体数目为14种,其中满足核磁共振氢谱要求的为:
,箭头为-CHO的可能位置,所以有满足条件的异构体数目为14种,其中满足核磁共振氢谱要求的为: 或
或 ;
;
(6)要合成![]() ,可在苯环上引入丙酰基,再还原,其合成路线为:
,可在苯环上引入丙酰基,再还原,其合成路线为: 。
。


科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥少量MgSO4固体
A. ①②③⑤B. ③C. ③④⑥D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某加碘食盐中是否含有![]() ,取相同食盐样品进行下表所示实验:下列说法中正确的是
,取相同食盐样品进行下表所示实验:下列说法中正确的是
(已知:![]() )
)
实验① | 实验② | 实验③ |
|
|
|
振荡,溶液迅速变为蓝色 | 振荡,一段时间后溶液变为浅蓝色 | 振荡,溶液变为浅黄色 |
A.仅由实验①就能证明食盐样品中存在![]()
B.实验②中发生反应的离子方程式为![]()
C.实验③能证明食盐样品中不存在![]()
D.以上实验说明离子的还原性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.当今社会,能源的发展已成为全世界共同关注的话题,乙烷、二甲醚的燃烧热较大,可用作燃料。如图1表示乙烷、二甲醚燃烧过程中的能量变化。
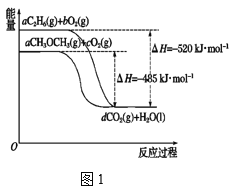
请回答下列问题:
(1)a=______。
(2)乙烷的燃烧热为______。
(3)等物质的量的C2H6(l)比C2H6(g)完全燃烧生成稳定的氧化物时放出的热量______(填“多”或“少”)。
(4)根据题图写出二甲醚完全燃烧时的热化学方程式:________。
(5)从环保角度分析,放出相同的热量时选择_______(填“乙烷”或“二甲醚”)作为燃料产生的二氧化碳较少。
Ⅱ.利用如图2装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/L NaOH 溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)大小烧杯中填充泡沫塑料的作用是_______。
(2)倒入NaOH溶液的正确操作是_______(从下列选出)。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒缓慢倒入
(3)使硫酸与 NaOH 溶液混合均匀的正确操作是_______。
(4)实验数据如下表:
温度实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ①_______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 29.8 | ||
②近似认为0.55mol/LNaOH溶液和0.25mol/L 硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=______(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol 有偏差,产生偏差的原因可能是________(请答出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.
A.①③⑤B.③④C.①②④D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是
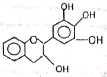
A.分子中所有的原子共面
B.1mol EGC与5mol NaOH恰好完全反应
C.易发生氧化反应和取代反应,可发生加成反应
D.遇FeCl3浴液不发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2HI(g)![]() H2(g)+I2(g,紫色),下列叙述能够说明已达平衡状态的是( )
H2(g)+I2(g,紫色),下列叙述能够说明已达平衡状态的是( )
A. 混合气体的质量不再变化
B. 温度和体积一定时,容器内压强不再变化
C. 1molH-H键断裂的同时有2molH-I键断裂
D. 各物质的物质的量浓度之比为2∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了以Ni / Al2O3 为催化剂,由CO2和H2转化为产品CH4的反应历程,其示意图如下:

下列说法不正确的是
A. 总反应方程式为:CO2+4H2![]() CH4+2H2O
CH4+2H2O
B. 催化剂可有效提高反应物的平衡转化率
C. 在反应历程中,H―H键与C=O键断裂吸收能量
D. 反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com