
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是 周期 族。
(2)A与C形成的18电子分子的结构式为 。
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如右图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
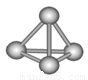
A.B4比P4(白磷)既含有极性键又含有非极性键
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为 。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
T/K | 303 | 313 | 323 |
BA3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
(1)三,ⅢA族
(2)H-O-O-H
(3)CD
(4)3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
(5)2Al+3H2O-6e-=Al2O3+6H+
(6)2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1530kJ·mol-1
【解析】根据题意已知条件推知,A、B、C、D、E、F为H、N、O、Al、S、Fe。
(2)A与C形成的18电子分子为双氧水,为共价化合物;
(3)B2和P4只有非极性键,因为只是同种非金属元素组成,故错误;l molB4气体转变为B2的△H=167×6-942×2=-882kJ·mol-1,是放出能量,错误;B4与B2互为同素异形体,正确;B4与B2分子中各原子最外电子层均达到8电子稳定结构,正确;
(4)过量的铁生成硝酸亚铁;
(5)铝失去电子生成氧化铝,2Al+3H2O-6e-=Al2O3+6H+;
(6)生成1molBA3(g)和C2时的能量变化值为382.5kJ,再根据表中数据判断该反应为吸热反应,即得方程式2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=+1530kJ·mol-1。


科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列在指定溶液中的各组离子,能够大量共存的是
A.使无色酚酞变红的溶液中:S2—、K+、CO32—、C1—
B.1mol·L—1的氯化铁溶液中:Na+、C1—、SCN—、Cu2+
C.PH=0的溶液中:S2—、I—、Mg2+、Ba2+
D.水电离的C(H+)=10—13mol·L—1的溶液中:Fe2+、SO42—、K+、NO3—
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
下列说法不正确的是
A.镁铝合金的熔点低于铝的熔点
B.把稀H2SO4加入NaAlO2溶液中生成白色沉淀然后沉淀又溶解
C.NaOH溶液不能长时间在分液漏斗中放置
D.蘸有浓硫酸的玻璃棒接近浓氨水瓶口有白烟产生
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合5 题型:简答题
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
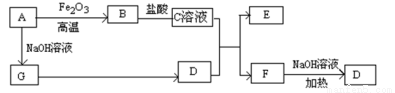
请回答下列问题:
(1)写出F的电子式 ;
(2)①C溶液与D反应的离子方程式为 ;
②F溶液与NaOH溶???共热反应的化学方程式为 ;
(3)①请用离子方程式解释C溶液为何显酸性 ;
②F溶液中离子浓度由大到小的顺序为 ;
(4)将5.4gA投入200mL 2.0mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是 (填代号)
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1molN2和3molG及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2mol/(L·min),则v(D)= mol/(L·min)
②在其他条件不变的情况下,若起始时充入0.5molN2和1.5molG达到平衡后,D的物质的量浓度 (填“大于”、“小于”或“等于”)a/2 mol/L。
③该条件下的平衡常数为 (用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合2 题型:简答题
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤,已知
SO2(g)+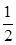 O2(g)
O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=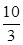 ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v正 v逆(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
A保持温度和容器体积 不变,充入1.0 mol O2
不变,充入1.0 mol O2
B保持温度和容器内压强不变,充入1.0 mol SO3
C降低 温度
温度
D移动活塞压缩气体
(4)若以右图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为 。
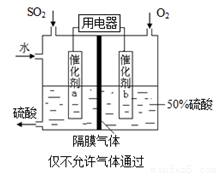
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为 。
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
某化学学习小组学习电化学后,设计了下面的实验装置图:
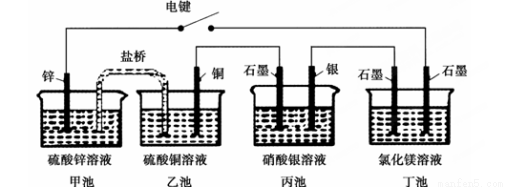
下列有关该装置图的说法中正确的是( )
A.合上电键后,盐桥中的阳离子向甲池移动
B.合上电键后,丙池为电镀银的电镀池
C.合上电键后一段时间,丙池中溶液的pH增大
D.合上电键后一段时间,当丙池中生成标准状况下560 mL气体时,丁池中理论上最多产生2.9 g固体
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳。其中一种镁电池的反应为xMg+Mo3S4 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )
A.放电时Mg2+向正极迁移
B.放电时正极反应为Mo3S4+2xe-===Mo3S42x-
C.充电时Mo3S4发生氧化反应
D.充电时阴极反应为Mg2++2e-===Mg
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:实验题
(16分)Na2S2O8溶液可降解有机污染物4-CP,原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-)。通过测定4-CP降解率可判断Na2S2O8溶液产生(SO4-·)的量。某研究小组探究溶液酸碱性、Fe2+的浓度对产生(SO4-·)的影响。

(1)溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
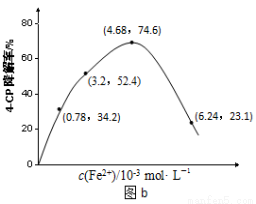
(2)Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。
已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+,此外还可能会发生:SO4-· + Fe2+ = SO42- + Fe3+
① 实验开始前,检验FeSO4溶液是否被氧化的试剂是 (化学式)。如被氧化可以观察到的现象是 。
②当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为 %,4-CP降解的平均反应速率的计算表达式为 。
③当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.1硅 无机非金属材料练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
B.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂的物质的量之比是3∶4
C.现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl
D.从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),没有发生氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com