
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|


科目:高中化学 来源: 题型:
 对硝基苯甲酸在医药、感光材料等工业中应用广泛.以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242℃,沸点约359℃,微溶于水,能升华.)的反应原理为:
对硝基苯甲酸在医药、感光材料等工业中应用广泛.以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242℃,沸点约359℃,微溶于水,能升华.)的反应原理为: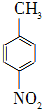 +Na2Cr2O7+4H2SO4→
+Na2Cr2O7+4H2SO4→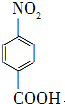 +Na2SO4+Cr2(SO4)3+5H2O
+Na2SO4+Cr2(SO4)3+5H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BzCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
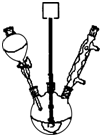
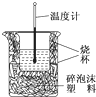 (1)在测定中和热的实验中,使用下列用品不是为了减小实验误差的是
(1)在测定中和热的实验中,使用下列用品不是为了减小实验误差的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12 mo1 |
| B、15 mo1 |
| C、16 mo1 |
| D、17 mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质的水溶液使红色石蕊试纸变蓝,该物质一定是碱 |
| B、某气体能使湿润淀粉碘化钾试纸变蓝,该气体一定是氯气 |
| C、某物质的水溶液中加入盐酸产生无色无味气体,该溶液一定含有碳酸根离子 |
| D、往铁和稀硝酸反应后的溶液中滴入KSCN溶液,溶液显血红色,则该反应后的溶液中肯定有Fe3+,可能还有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 解释 | |
| A | 向某卤代烃在碱性条件下水解后的溶液中滴加硝酸银溶液,有白色沉淀产生,证明该卤代烃是氯代烃. | 因为氯代烃水解后的溶液中含Cl-,加入硝酸银溶液产生AgCl白色沉淀. |
| B | 向溴水中加入苯充分振荡,静置分层,且水层几乎无色. | 苯与溴水发生加成反应所以溴水褪色 |
| C | 要除去甲烷中混有的乙烯,可以将混合气体通入到酸性高锰酸钾溶液中,再通过浓硫酸干燥 | 因为乙烯可以被酸性高锰酸钾溶液氧化,而甲烷不能被氧化. |
| D | 向蔗糖在酸性条件下水解的溶液中加NaOH溶液直至呈碱性,再加入新制的Cu(OH)2悬浊液,加热,产生砖红色沉淀. | 说明蔗糖水解产生了葡萄糖. |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已经潮解 |
| B、定容时仰视刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、称量时所用砝码生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
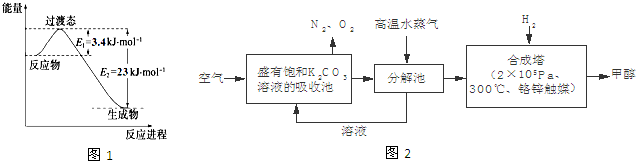
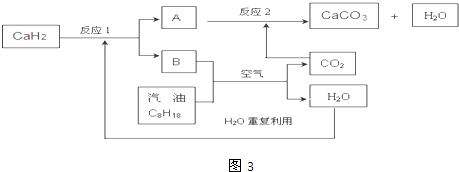
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com