
某课外活动小组同学用如图装置进行实验,试回答下列问题。 
(1)若开始时开关K与b连接,则B极的电极反应式为 ,总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(2)上述实验反应一小段时间后,再把开关K与a连接,则B极的电极反应式为 。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,则可以设想用如下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填”大于”或”小于”或”等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填写“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
⑤燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。液态肼(分子式N2H4)可以在氟气中燃烧生成氮气和氟化氢。利用肼、氟气与KOH溶液组成碱性燃料电池,请写出该电池负极的电极反应式:? ? .
(1)2H++2e-=H2↑ 2Cl-+ 2H2O 2OH-+H2↑+Cl2↑;②
2OH-+H2↑+Cl2↑;②
(2)Fe-3e-+3OH-=Fe(OH)3
(3)①4OH--4e-= 2H2O+O2↑;小于
②D
③氢离子放电,促进水的电离,氢氧根离子浓度增大;
④O2+2H2O+4e-= 4OH-;
⑤N2H4-4e-+4OH-=N2↑+4H2O.
解析试题分析:(1)开关K与b连接是电解饱和食盐水,B极为阴极,电极反应式为2H++2e-=H2↑总反应的离子方程式为2Cl-+ 2H2O 2OH-+H2↑+Cl2↑;①阳离子向阴极移动,错误;②A极产生氯气,使湿润KI淀粉试纸变蓝,正确;③电解时从溶液中失去的是氯气和氢气,一段时间后加入HCl可恢复到电解前电解质的浓度,而不是盐酸,错误;④ 溶液不能转移电子,错误;
2OH-+H2↑+Cl2↑;①阳离子向阴极移动,错误;②A极产生氯气,使湿润KI淀粉试纸变蓝,正确;③电解时从溶液中失去的是氯气和氢气,一段时间后加入HCl可恢复到电解前电解质的浓度,而不是盐酸,错误;④ 溶液不能转移电子,错误;
(2)开关K与a连接装置为原电池,正极是氯气得到电子,负极为铁失去电子,变为+3价铁,电解反应式为Fe-3e-+3OH-=Fe(OH)3;
(3)①阳极氢氧根离子失去电子,4OH--4e-= 2H2O+O2↑;硫酸根离子通过阴离子交换膜,钾离子通过阳离子交换膜,故此时通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;②阴极氢离子放电生成氢气和碱,故在阴极产生氢氧化钾,从D口出;③氢离子放电,促进水的电离,氢氧根离子浓度增大;④该电池负极为氢气失去电子,正极为氧气得到电子,正极的电极反应式为O2+2H2O+4e-= 4OH-;⑤该电池肼在负极失去电子,注意碱性介质,需结合氢氧根离子生成水,负极电极反应式为N2H4-4e-+4OH-=N2↑+4H2O.
考点:考查电化学有关问题。


科目:高中化学 来源: 题型:填空题
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为___________________________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是____________(填序号)。
a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式),电极反应式为____________________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以黄铜矿精矿为原料,制取金属铜的工艺如下所示: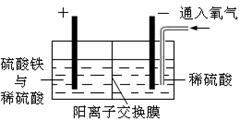
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如图所示装置进行电化学浸出实验。将精选黄铜矿粉加入电解槽的阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:CuFeS2 + 4H+=Cu2+ + Fe2+ + 2H2S↑ 2Fe3+ + H2S=2Fe2+ + S↓+ 2H+ ,阳极区硫酸铁的主要作用是 。(2)阴极区,电极上开始时有大量气泡产生,后有红色固体析出,一段时间后红色固体溶解。写出析出红色固体的反应方程式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝: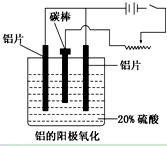
2Al2O3  4Al+3O2↑
4Al+3O2↑
加入冰晶石的作用:________________________________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________________,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_____________________________________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(5)下列说法正确的是__________________。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。请回答:
①通入O2的电极名称是 ,B电极的名称是 。
②通入CH3OH的电极的电极反应式是 ,A电极的电极反应式为 。
③乙池体积为1L,在AgNO3足量的情况下电解一段时间后溶液的PH变为1,则在这段时间内转移的电子数目为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
部分难溶物的颜色和常温下的Ksp如下表所示:
| | Cu(OH)2 | CuOH | CuCl | Cu2O |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25 ℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | — |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池放电时,发生还原反应的物质是 (填字母,下同)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)下列有关该电池的说法中正确的是
A.放电时电解质溶液显强酸性
B.放电时5.6g Fe全部转化为Fe(OH)2时,外电路中通过了0.2 mol电子
C.充电时阳极反应为Ni(OH)2+2OH-?2e-==NiO2+2H2O
D.充电时阴极附近溶液的碱性保持不变
(3)用此蓄电池电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,电解池的电极均为惰性电极。当溶液中的Cu2+ 全部转化成Cu时,阳极产生的气体在标准状况下的体积为 ;将电解后的溶液加水稀释至1L,此时溶液的pH= 。
(4)用此蓄电池进行电解,且电解池的电极均为铜电极,电解质溶液为浓碱液与NaCl溶液的混合液,电解一段时间后,同学们惊奇地发现,阳极附近不是生成蓝色沉淀,而是生成红色沉淀,查阅资料得知该红色沉淀是Cu2O。写出该阳极上的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求填空: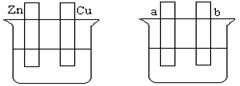
A B
(1)在A图中,稀硫酸为电解质溶液,用导线连接后,铜片电极反应式 。
(2)在B图中外接直流电源,若要在a极镀铜,加以必要的连接后,该装置叫 ,b极电极反应式 。
(3)在B图中外接直流电源,若电极为惰性电极,电解质溶液是CuSO4溶液(足量),电解总反应离子方程式为 ,阴极增重3.2 g,则阳极上放出的气体在标准状况下的体积是_____L,加入一定量的 后(填化学式),溶液能恢复至与电解前完全一致。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在25℃时,用石墨电极电解 ,
, 溶液,如有
溶液,如有 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题:
(1)阴极发生 反应,电极反应为 。
(2)阳极发生 反应,电极反应为 。
(3)电解后得到的 的质量是 ,得到
的质量是 ,得到 的体积(标准状况)是 。
的体积(标准状况)是 。
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的 (填“变小”、“变大”或“不变”)
(填“变小”、“变大”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com