
【题目】将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在T1温度下进行反应生成SO3(g),得到下表中的数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
(1)x=_________。
(2)实验1从开始到达到化学平衡时,用去时间2分钟,则υ(SO2)表示的反应速率为:______________________。
(3)写出两个能加快上述反应的措施:______________________、_____________________。
【答案】1.6 0.6 mol/(L·min) 加压 加热或增加反应物或产物浓度(任选两个作答)
【解析】
(1)分析图表数据,依据化学平衡三段式列式,结合转化的物质的量之比等于相应物质的化学计量数之比进行计算;
(2)结合反应速率概念计算;
(3)根据化学反应速率的影响因素作答。
(1)实验1从开始到反应达到化学平衡时,

因转化的氧气物质的量为2 mol -0.8 mol =1.2 mol,根据参与反应各物质的物质的量之比等于化学计量数之比可知,转化的二氧化硫的物质的量为1.2mol×2=2.4mol,所以x(mol) = 4 mol-2.4 mol=1.6mol,
故答案为:1.6;
(2)根据上述三段式结合速率的定义式可知,v(SO2)表示的反应速率=![]() = 0.6 mol/(Lmin),
= 0.6 mol/(Lmin),
故答案为:0.6 mol/(Lmin);;
(3)上述可逆反应中,加压,加热或增加反应物或产物浓度均可加快化学反应速率,
故答案为:加压,加热或增加反应物或产物浓度。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
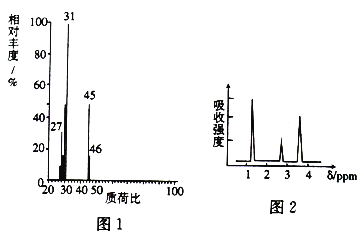
【题目】为探究某有机化合物A的结构及性质,进行如下实验:
I.确定分子式
(1)将有机物A置于氧气流中充分燃烧实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则A中各元素的原子个数比为______________。
(2)A的质谱图如图1所示,则A的分子式为_____________。
II.结构式的确定
(3)经测定,A的核磁共振氢谱图如图2所示,则A的结构简式为____________。
III.性质实验
(4)A在一定条件下可脱水生成无色气体B,该反应的化学方程式为____________。
(5)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉。制备氯乙烷的一个好方法是用A与SOCl2加热下反应,同时生成二氧化硫和氯化氢两种气体,则该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。
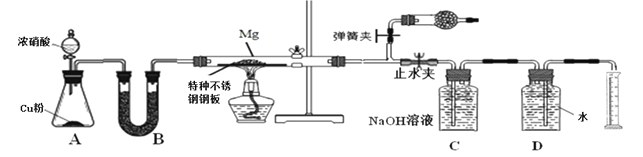
(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关卤素单质的说法正确的是
A.从F2到I2,单质密度逐渐减小B.从F2到I2,单质氧化性增强
C.H2与F2不能共存D.碘与铁反应时生成FeI3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g46%甲酸(HCOOH)水溶液所含的氧原子数为5NA
B. 标准状况下,18g冰水中共价键的数目为NA
C. 56g铁与71gCl2充分反应,转移电子数目为3NA
D. 7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢元素有三种同位素H、D、T,氯元素有两种同位素35Cl、37Cl。当用一种仪器分别测定10000个氯化氢的相对分子质量,所得数值最多有多少种?
A.2种B.5种C.6种D.10000种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代。正确的是( )
A.原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动
B.目前我国广大农村生活做饭使用的都是化石原料
C.多能源时代指的是新能源时代,包括核能、太阳能、氢能
D.化石燃料的燃烧没有污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的数値,下列说法正确的是( )
A. 常温常圧下,7.0g由丁烯与丙烯組成的混合气体中含有的氢原子数目为NA
B. 向1L的密闭容器中充入46gNO2气体,容器中气体的分子数为NA
C. 6.4g铜与足量的硫单质混合加热,转移电子的数目为0.2NA
D. 标准状况下,2.24LSO3中含有0.1NA个SO3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物(主要为NO和NO2)污染是“蓝天计划”的重要内容之一。
(1)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为NO和NO2)污染, NO、O2和CH4的混合物反应体系主要发生如下反应:
2NO(g) + O2(g)![]() 2NO2(g) ΔH=-113.0 kJmol-1 ①
2NO2(g) ΔH=-113.0 kJmol-1 ①
CH4(g) + 2O2(g)![]() CO2(g) +2H2O (g) ΔH=-802. 3 kJmol-1 ②
CO2(g) +2H2O (g) ΔH=-802. 3 kJmol-1 ②
CH4(g) + 4NO(g)![]() 2N2(g) + CO2(g) + 2H2O (g) ΔH=-1160kJmol-1 ③
2N2(g) + CO2(g) + 2H2O (g) ΔH=-1160kJmol-1 ③
① 则反应CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O (g)的ΔH= ______。
N2(g)+CO2(g)+2H2O (g)的ΔH= ______。
② 反应CH4(g) + 2O2(g)![]() CO2(g) +2H2O (l) ΔH=-a kJmol-1,则a ____ 802. 3(填“>”、“<”或“=”)。
CO2(g) +2H2O (l) ΔH=-a kJmol-1,则a ____ 802. 3(填“>”、“<”或“=”)。
③ 在一定温度下,提高反应③中NO 转化率可采取的措施是 _____。
(2)利用电化学装置可消除氮氧化物污染,变废为宝。

① 图Ⅰ装置实现的能量转化形式是_____。石墨Ⅱ电极上发生的电极反应方程式为_____。相同条件下,放电过程中消耗的NO2和O2的体积比为_____。
② 图Ⅱ为电解NO制备NH4NO3的装置。该装置中阳极的电极反应式为_____。“反应室”中发生反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com