
【题目】下列表示不正确的是( )
A. 氯离子的结构示意图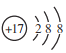 B. 四氯化碳分子的电子式:
B. 四氯化碳分子的电子式: 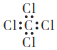
C. CH4的球棍模型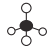 D. 明矾的化学式:KAl(SO4)2·12H2O
D. 明矾的化学式:KAl(SO4)2·12H2O
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式________________。
为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有_____________(写出两条)。
(2) “浸渣”中除含有某种有磁性的物质外,还含有的物质是_____(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是__________。然后再调节溶液的pH约为5,目的是______________。
(4)“粗硼酸”中的主要杂质是________(填名称)。
(5)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程_____________、 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~E均含同种元素,都是中学化学中常见的物质,C为蓝色不溶于水的固体,它们可发生如下图所表示的反应(除A~E外的其他物质已略去):

(1)写出相应物质的类别:
物质 | B | C | D |
类别 | ___________ | ______________ | ______________ |
(2)在以上反应中(用序号填空):
属于氧化还原反应的是________;属于复分解反应的是________。
(3)写出反应③和⑦的离子方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如下,下列说法正确的是
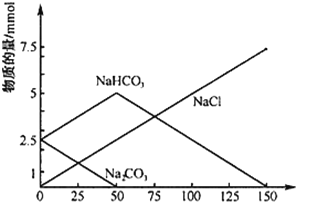
A. 标注 NaCl的直线代表产生的CO2的物质的量
B. 原混合物中Na2CO3与NaHCO3的物质的量之比为1:2
C. 盐酸的浓度是0.05 mol/L
D. 盐酸加到150mL时,放出CO2气体2.24L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是____(填离子符号);实验①和③说明:在I-过量的情况下,
溶液中仍含有___(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_______________;生成沉淀的原因是__________________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的叙述中正确的是
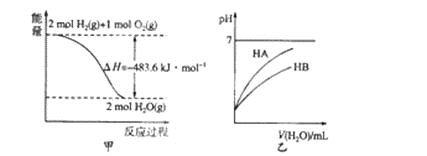
A. 图甲表示l mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量
B. 图甲表示2 mol H2(g)所具有的能量比2 mol H2O(g)所具有的能量多483.6 kJ
C. 图乙表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温、同浓度的NaA溶液的pH小于NaB溶液的pH
D. 图乙中起始时HA的物质的量浓度大于HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂
B. 图Ⅱ表示一定条件下进行的反应2SO2+O2![]() 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
C. 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全
D. 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A. 酸性B. 碱性C. 还原性D. 氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com