
 氟的单质及其化合物在工农业生产中应用非常广泛.回答下列问题:
氟的单质及其化合物在工农业生产中应用非常广泛.回答下列问题:| 化合物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| 莫氏硬度 | 3.2 | 6.0 | 无 |
分析 (1)氟原子最外层为L层,含有7个电子,据此写出外围电子排布式,并结合电子排布式判断氟元素所在的区;
(2)NaHF2中含有离子键、共价键,F的电负性较强,还存在氢键;
(3)根据O原子的价层电子对数判断杂化类型;
(4)①根据晶体类型不同,以及同种晶体类型影响微粒之间作用力的因素分析表中氟化物熔点差异的原因;
②结合晶格能判断两者莫氏硬度差异的原因;
(5)①根据图示的晶胞结构判断钙离子、氟离子的配位数;
②该晶胞为立方体结构,根据棱长计算出该晶胞体积,再结合ρ=$\frac{m}{V}$计算出氟化钙晶体的密度.
解答 解:(1)基态氟原子的外围含有7个电子,其外围电子排布式为:2s22p5,在元素周期表中属于p区;
故答案为:2s22p5;p;
(2)NaHF2为离子化合物,存在离子键,H-F键为共价键,F的电负性较强,还存在氢键,
故答案为:离子键、共价键、氢键;CO2(或Na2O);
(3)OF2分子中氧原子为2+$\frac{1}{2}$(6-2×1)=4,属于sp3杂化;
故答案为:sp3;
(4)①NaF为离子晶体,SiF4为分子晶体,分子晶体的熔点比离子晶体低,故SiF4的熔点低;故答案为:NaF为离子晶体,SiF4为分子晶体,由于离子键比分子间作用力强得多,故NaF的熔点高于SiF4;
②MgF2和NaF都是离子晶体,它们的阴离子都是F-,而Mg2+的半径比Na+小,Mg2+所带电荷数比Na+多,则MgF2晶格能大于NaF,故MgF2的莫氏硬度大于NaF;故答案为:MgF2和NaF都是离子晶体,它们的阴离子都是F-,而Mg2+的半径比Na+小,Mg2+所带电荷数比Na+多,则MgF2晶格能大于NaF,故MgF2的莫氏硬度大于NaF;
(5)①在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8;在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4,
故答案为:8;4;
②该晶胞中含有钙离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氟离子在该晶胞的内部,所以氟离子个数是8,该晶胞中含有4个CaF2,该晶胞的体积为:V=(5.55×10-6)3cm3,该晶胞的密度为ρ=$\frac{m}{V}$=$\frac{4×78}{{N}_{A}•(5.55×1{0}^{-6})^{3}}$g•cm-3,
故答案为:$\frac{4×78}{{N}_{A}•(5.55×1{0}^{-6})^{3}}$.
点评 本题考查了晶胞计算,题目难度中等,涉及原子核外电子排布、原子轨道杂化方式及杂质类型、晶胞结构及计算等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学计算能力,注意掌握晶胞的结构及计算方法,明确原子核外电子排布规律及原子轨道杂化类型的判断方法.


科目:高中化学 来源: 题型:选择题
| A. | 使用布袋购物、以步代车属于“低碳生活”方式 | |
| B. | 饮用水中矿物质的含量越高越有利于人体健康 | |
| C. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| D. | 采用光触媒技术可将汽车尾气中的NO和CO转化为无毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入5 mL 0.01mol/L NaOH,所得溶液中离子的浓度一定符合:c(Na+)+c(H+)═c(OH-)+c(ClO-) | |
| B. | 25℃时,若溶液的pH=5,则Ka(HClO)=l×10-7 | |
| C. | 向溶液中加入少量NH4Cl固体,溶液中$\frac{c(HClO)}{c(Cl{O}^{-})}$的值变小 | |
| D. | 向溶液中加入10 mL O.01mol/L NaOH,所得溶液中离子浓度的大小顺序为:c(Na+)>c(ClO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
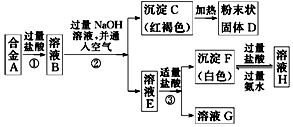 铁和铝是日常生活中用途广泛的金属.
铁和铝是日常生活中用途广泛的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:戊烷>2-甲基丁烷>乙二醇 | |
| B. | 密度:硝基苯>H2O>汽油 | |
| C. | 等质量的物质燃烧耗O2量:乙烯>乙炔>甲烷 | |
| D. | 等物质的量物质燃烧耗O2量:丙烷>环丙烷>2-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3>PH3>AsH3 | B. | 离子半径:Li+>O2->F- | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:LiOH<NaOH<KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
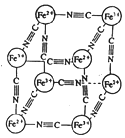 分析化学中常用 X 射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和 Fe3+分别占据立方体的顶点,自身互不相邻,而 CN-位 于立方体的棱上.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用 X 射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和 Fe3+分别占据立方体的顶点,自身互不相邻,而 CN-位 于立方体的棱上.晶体的晶胞结构如图所示,下列说法不正确的是( )| A. | 该晶体中含有共价键,是离子晶体 | |
| B. | M 离子位于晶胞面心,呈+2 价 | |
| C. | M 离子位于晶胞体心,呈+1 价,且 M+空缺率为 50%(体心中没有 M+占总体心的百分比) | |
| D. | 晶体的化学式可表示为 MFe2(CN)6,且 M 为+1 价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{20}^{40}$Ca 和${\;}_{18}^{40}$Ar | B. | D和T | ||
| C. | H2 O和H2 O2 | D. | O3 和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl 的溶解性强于 H2S | B. | 氯的最高价为+7 价 | ||
| C. | H2S 中的 S2-能被 Cl2氧化 | D. | HCl O 的氧化性强于 H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com