
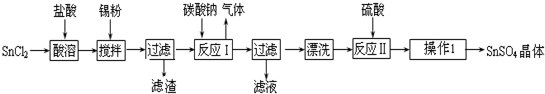
分析 SnCl2溶解得到溶液加入碳酸钠沉淀锡离子,过滤得到沉淀洗涤后加入硫酸溶解得到硫酸锡溶液,蒸发浓缩冷却结晶,过滤洗涤得到硫酸锡晶体.
(1)锡原子的核电荷数为50,与碳元素属于同一主族,处于ⅣA族,根据原子序数减去各周期容纳元素种数确定所在的周期;
(2)洗涤沉淀在过滤装置中进行;
(3)由信息可知,SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(4)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水;
(6)用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O,根据电子转移守恒与方程式可得关系式Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,以此计算.
解答 解:SnCl2溶解得到溶液加入碳酸钠沉淀锡离子,发生Sn2++CO32-═SnO↓+CO2↑,过滤得到沉淀洗涤后加入硫酸溶解得到硫酸锡溶液,蒸发浓缩冷却结晶,过滤洗涤得到硫酸锡晶体.
(1)锡元素与碳元素属于同一主族,处于ⅣA族,原子核电荷数为50,则:50-2-8-8-18=14,故Sn处于第五周期,则在周期表中的位置为第五周期第ⅣA族,
故答案为:第五周期第ⅣA族;
(2)洗涤SnSO4沉淀的方法是利用过滤装置进行洗涤,向过滤器中加入蒸馏水至浸没沉淀,待水完全流出后重复操作2-3次,
故答案为:向过滤器中加入蒸馏水至浸没沉淀,待水完全流出后重复操作2-3次;
(3)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案为:SnCl2水解,发生SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
(4)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:调节溶液pH;防止Sn2+被氧化;
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O;
(6)用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O,令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7
119g $\frac{1}{3}$mol
1.226g×x 0.100mol/L×0.032L
故 $\frac{119}{1.226x}$=$\frac{\frac{1}{3}}{0.100×0.32}$,
解得x=93.2%,
故答案为:93.2%.
点评 本题以SnSO4的制备为载体考查学生对工艺流程的理解、混合物的分离提纯,为高频考点,把握实验流程、阅读题目获取信息为解答的关键,涉及常用化学用语书写、滴定应用及利用关系式进行的计算等,综合性较强,题目难度中等,对学生的基础知识及逻辑推理有较高的要求.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 产率 | 75% | 65% | 88% | 72% |
| 教师对产率的评价 | 偏低 | 偏低 | 偏高 | 偏低 |
| A. | 第1组:过滤时滤纸有气泡 | |
| B. | 第2组:没有蒸发干,精盐中仍然有水分 | |
| C. | 第3组:过滤时滤液高于滤纸的边缘 | |
| D. | 第4组:滤液中还有少量泥沙就开始蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷能燃烧,乙烯不能 | |
| B. | 甲烷和乙烯都能使溴水褪色 | |
| C. | 甲烷和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷和乙烯完全燃烧的产物都是CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| B. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| C. | 除去溴苯中少量的溴,可以加水后分液 | |
| D. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol/L | B. | 1.8 mol/L | C. | 1.9 mol/L | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com