
分析 (1)用pH试纸测定的具体测定方法是用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
(2)根据盐的类型分析;根据水解程度分析.
解答 解:(1)用pH试纸测定的具体测定方法是用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH,故答案为:用玻璃棒蘸取待测液滴在PH试纸上,然后与标准比色卡对比;
(2)纯碱是强碱弱酸盐,碳酸根离子能发生水解使溶液中的氢氧根离子的浓度大于氢离子的浓度,导致溶液呈碱性,离子方程式为 CO32-+H2O?HCO3-+OH-;在25℃时,因为溶液呈碱性,所以pH值大于7,虽然碳酸钠能水解,假设碳酸根离子全部水解,溶液中氢氧根离子的浓度为0.01mol/L,PH值=12,但水解是微弱的,不能使碳酸根离子全部水解,所以pH值小于12,故答案为:CO32-+H2O?HCO3-+OH-;12.
点评 本题考察了实验基本操作、pH试纸的正确使用方法、盐类水解的应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图为  | |
| B. | 质量数为37的氯原子${\;}_{17}^{37}$Cl | |
| C. | 氯化镁的电子式:Mg2+[Cl]2 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
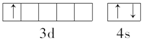 ,该元素基态原子结构示意图
,该元素基态原子结构示意图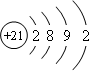 .该元素的名称为钪,形成的单质为金属晶体.
.该元素的名称为钪,形成的单质为金属晶体. 中心原子的杂化方式为
中心原子的杂化方式为查看答案和解析>>
科目:高中化学 来源: 题型:解答题
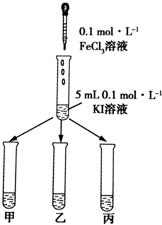 某学习小组通过下面的实验一和实验二,探究某些化学理论.
某学习小组通过下面的实验一和实验二,探究某些化学理论.| 序号 | 反应温度/℃ | C(HCl)/mol•L-1 | V(HCl)/ml | 10g碳酸钙的形状 | t/min |
| ① | 20 | 2 | 10 | 块状 | t 1 |
| ② | 20 | 4 | 10 | 块状 | t 2 |
| ③ | 20 | 2 | 10 | 粉末 | t 3 |
| ④ | 40 | 2 | 10 | 粉末 | t 4 |
| ⑤ | 40 | 4 | 10 | 粉末 | t5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅(1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | 以上都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
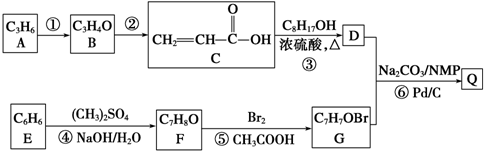
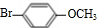 .
.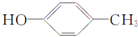 .
. +
+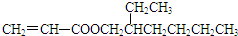 $→_{Na_{2}CO_{3}/NMP}^{Pd/C}$
$→_{Na_{2}CO_{3}/NMP}^{Pd/C}$ 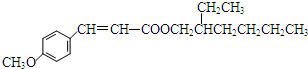 +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检溶液,向其中加入浓NaOH溶液加热,再用湿润的蓝色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量的苯酚的苯中加入过量的浓溴水,震荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 除去淀粉溶液中的氯化钠:用蒸馏水渗析法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com