
【题目】孔雀石主要含Cu2(OH)2CO3以及少量Fe、Si的化合物。可以用孔雀石为原料制备胆矾(CuSO4·5H2O) 步骤如下:
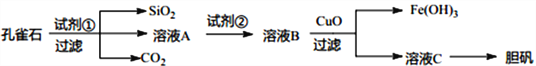
请回答下列问题:
(1)试剂①是一种常见的酸,写出其化学式__________。过滤所需要的玻璃仪器有__________。
(2)实验室检验Fe3+的常用方法是________________。
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+,从而形成溶液B,则试剂②能否用氯水________________(填“能”或“不能”若“不能”,请解释原因)。
(4)由溶液C获得胆矾,需要经过________、__________、过滤等操作。
(5)取25.00mL溶液A,用1.000×10-2mol/LKMnO4标准溶液滴定。反应离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为_______________。
【答案】 H2SO4 漏斗、烧杯、玻璃棒 取样,向其中滴加KSCN溶液,溶液呈血红色,则含有Fe3+ 不能,会引入新的杂质 蒸发浓缩 冷却结晶 0.040mol/L
【解析】因目标产物为硫酸铜晶体,则需向孔雀石中加入足量稀硫酸,发生的反应有Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑,溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,铁的氧化物溶于稀硫酸生成铁盐、亚铁盐和水,然后过滤得到的滤渣中含有Si的氧化物,溶液A中含有含有铁盐和亚铁盐及硫酸铜,气体E为CO2,向溶液A中加入试剂①得到溶液B,试剂②是一种氧化剂,将Fe2+转化为Fe3+且不能引进杂质,应该选取双氧水,向溶液B中加入CuO调节溶液pH,经过过滤操作得到溶液C和红褐色沉淀Fe(OH)3,溶液C为硫酸铜溶液,再蒸发结晶最终得胆矾晶体;
(1)试剂①是硫酸,化学式为H2SO4;过滤操作所需要的玻璃仪器有漏斗、烧杯、玻璃棒;
(2)检验Fe3+的常用方法是取样,向其中滴加KSCN溶液,溶液呈血红色,则含有Fe3+;
(3)除杂的原则是不能引入新的杂质,如果选用氯水,则制得的胆矾晶体中可能会混有CuCl2,故试剂②不能氯水;
(4)将硫酸铜溶液蒸发浓缩、冷却结晶、再过滤即得胆矾;
(5)根据5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,KMnO4的物质的量为1.000×10-2mol/L×0.02L=2×10-4mol,则溶液A中Fe2+的浓度为2×10-4mol×5÷0.025L=0.040mol/L。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也.”这里所用的“法”是指( )
A.萃取
B.渗析
C.蒸馏
D.干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法不正确的是( )
A.氧化反应和还原反应一定同时发生
B.一定有单质参加反应
C.反应前后一定有元素的化合价发生变化
D.氧化剂一定是反应过程中得到电子的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液,①碘水中提取单质碘 ②碘和四氯化碳的混合物 ③汽油和氯化钠溶液,分离以上混合物的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是

A. 布洛芬的分子式为C13H18O2 B. 布洛芬与苯乙酸是同系物
C. 1mol布洛芬最多能与3mol氢气发生加成反应 D. 布洛芬在苯环上发生取代反应,其一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:
IA | IIA | ⅢA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是_______________(填写元素符号);①的核外电子排布式_______;③和⑥两元素形成化合物的电子式为________。
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是__________(填化学式)。
(3)比较④、⑤两种元素的简单离子半径:___>____(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为__________________。
(4)列举一个事实来证明元素①比元素⑤的非金属性强__________________。
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 |
①实验1、2研究的是________________对H2O2分解速率的影响。
②实验2、3的目的是_______________。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性分析:如图甲可通过观察________________,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_______________。
②定量分析:如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是_____________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是 热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是____________________的影响。要证明你的猜想,实验方案是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 石油分馏可以获得乙烯
B. 煤经过气化和液化等物理变化可转化为淸洁燃料
C. 聚乙烯塑料制品可用于食品包装
D. 天然气和液化气的主要成分都是甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大。已知:
①C的简单气态氢化物遇湿润的红色石蕊试纸变蓝色;
②A与D可以形成原子个数比分别为2∶1、1∶1的两种液态化合物X和Y,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种化合物F,其组成原子数之比为5∶1∶1∶3。
请回答下列问题:
(1)C原子在周期表的位置为_____________;D的原子结构示意图为_____________;写出化合物EDA的电子式__________。
(2)C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐,写出其化学式___________;写出Y的结构式_____________。
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为_______________________。
(4)氯气与C的简单气态氢化物相遇有白烟及C2生成,写出反应方程式______________。
(5)用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ·mol-1
N2O4(g) ΔH=-56.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:____________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com