
| 容器编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | |
| H2 | CO2 | HCOOH | |||
| Ⅰ | 150 | 0.4 | 0.4 | 0.2 | 2 |
| Ⅱ | 150 | 0.8 | 0.8 | t1 | |
| Ⅲ | 0.4 | 0.4 | 0.16 | t2 | |
| A. | 反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=0.1mol/(L•min) | |
| B. | 反应达到平衡时,容器Ⅱ所需时间t2<2min | |
| C. | 若只改变一个反应条件,容器Ⅲ可能是加入了合适的催化剂 | |
| D. | 起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2和0.18molHCOOH,则反应向正反应方向进行 |
分析 A.由反应可知,参加反应的氢气等于甲酸的物质的量,均为0.2mol,结合v=$\frac{△c}{△t}$计算;
B.II中物质的量为I中物质的量的2倍,压强增大,反应速率增大;
C.I与III比较,开始的物质的量相同,但平衡时HCOOH的物质的量小,则平衡逆向移动;
D.I与II温度相同,K相同,由I可知,
H2(g)+CO2(g)?HCOOH(g)
开始 0.2 0.2 0
转化 0.1 0.1 0.1
平衡 0.1 0.1 0.1
K=$\frac{0.1}{0.1×0.1}$=10,
起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2和0.18molHCOOH,Qc=$\frac{0.09}{0.225×0.1}$,比较Q与K判断反应进行的方向.
解答 解:A.由反应可知,参加反应的氢气等于甲酸的物质的量,均为0.2mol,反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=$\frac{0.1mol/L}{2min}$=0.05mol/(L•min),故A错误;
B.II中物质的量为I中物质的量的2倍,压强增大,反应速率增大,则反应达到平衡的时间减小,即t2<2min,故B正确;
C.I与III比较,开始的物质的量相同,但平衡时HCOOH的物质的量小,则平衡逆向移动,可能为减小压强,而催化剂不影响平衡移动,故C错误;
D.I与II温度相同,K相同,由I可知,
H2(g)+CO2(g)?HCOOH(g)
开始 0.2 0.2 0
转化 0.1 0.1 0.1
平衡 0.1 0.1 0.1
K=$\frac{0.1}{0.1×0.1}$=10,
起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2和0.18molHCOOH,Qc=$\frac{0.09}{0.225×0.1}$=4<K,平衡正向移动,故D正确;
故选BD.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、K及速率的计算为解答的关键,侧重分析与计算能力的考查,注意选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
 将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示:
将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,12g石墨晶体中所含六元环数目为NA | |
| B. | 标准状况下,18g D2O中所含电子数为9 NA | |
| C. | 1mol N2与 4mol H2反应生成的NH3分子数为2NA | |
| D. | 标准状况下,2.24L SO3中所含原子数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
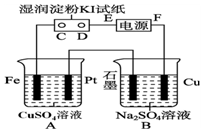 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要除去含有 A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2 | |
| B. | 还原性强弱顺序为:A2+>B->Z->X2+ | |
| C. | X2+是 XO4- 的还原产物,B2是 B-的氧化产物 | |
| D. | 在溶液中可能发生反应:XO4-+5 A2++8H+=X2++5A3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杜绝铝制品在生产生活中的应用 | |
| B. | 不能用铝制器皿长期存放酸性或碱性食品 | |
| C. | 不吃或少吃使用了含铝食品添加剂的食物 | |
| D. | 氢氧化铝可用于药物治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
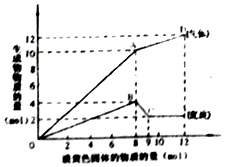 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )| A. | 溶液中一定含有Mg2+、NH4+、Al3+,可能含有Fe2+ | |
| B. | 图中A点产生的气体总质量为230克 | |
| C. | 图中A到D之间会产生有刺激性气味的气体 | |
| D. | 图中B到C之间发生的化学反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )| A. | 溶液中OH-、导线中的电子都向电极a移动 | |
| B. | N2在正极生成 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 电极b的反应式为O2+4H++4e-=2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com