
| A. | 从1L、1mol/L NaCl溶液中取出10mLNaCl溶液,其浓度仍为1mol/L | |
| B. | 配制0.5L、10mol/L的盐酸,需要氯化氢气体112升(标况) | |
| C. | 0.5L、2mol/L BaCl2溶液中Ba2+ 和 Cl-的总个数约为3×6.02×1023 | |
| D. | 10g、98%的浓硫酸(密度为1.84g/cm3 )与10mL、1.84mol/L的浓硫酸浓度不同 |
分析 A、溶液是均一稳定的,所取溶液的浓度和体积无关;
B、求出HCl的物质的量n=CV,然后根据体积V=nVm来计算;
C、求出氯化钡的物质的量,然后根据氯化钡中含1个钡离子和2个氯离子来分析;
D、物质的量浓度c=$\frac{1000ρω}{M}$.
解答 解:A、溶液是均一稳定的,所取溶液的浓度和体积无关,故从1L1mol/L NaCl溶液中取出10mLNaCl溶液,其浓度仍为1mol/L,故A正确;
B、0.5L10mol/L的盐酸溶液中HCl的物质的量n=CV=10mol/L×0.5L=5mol,所需的HCl气体在标况下的体积V=nVm=5mol×22.4/mol=112L,故B正确;
C、溶液中氯化钡的物质的量n=CV=2mol/L×0.5L=1mol,而氯化钡中含1个钡离子和2个氯离子,故1mol氯化钡中含氯离子和钡离子共3NA个,故C正确;
D、98%的密度为1.84g/mL的浓硫酸的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,与10mL、18.4mol/L的浓硫酸浓度相同,故D错误.
故选D.
点评 本题考查了物质的量浓度和微粒个数的计算,难度不大,注意公式的运用和计算熟练程度的训练.


科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液中:H+、NH4+、SO42-、Br- | |
| B. | 滴加苯酚显紫色的溶液:CO32-、Na+、NO3-、SO42- | |
| C. | 在c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | 能溶解氢氧化铝的溶液中:Na+、K+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属材料 | B. | 复合材料 | C. | 无机非金属材料 | D. | 合成高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用互滴的方法鉴别NaOH溶液和AlCl3溶液 | |
| B. | 除去MgCl2中少量AlCl3可用氨水 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 | |
| D. | 用丁达尔效应鉴别NaCl溶液和KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 | |
| B. | 可用稀硝酸鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液 | |
| C. | 将Mg(OH)2沉淀转入烧杯中,加足量稀硫酸溶解,加热浓缩、冷却结晶、过滤后得到晶体 | |
| D. | 除去乙酸乙酯中的乙酸杂质:加入氢氧化钠溶液,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦发现抗疟新药青蒿素而获得诺贝尔奖 | |
| B. | 氯气用作自来水的杀菌消毒剂 | |
| C. | 医用消毒酒精中乙醇的浓度(体积分数)为95% | |
| D. | 燃料不完全燃烧排放的CO是大气污染物之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
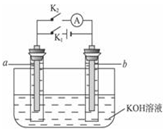 如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| B. | 断开K2,闭合K1一段时间,溶液的pH要变大 | |
| C. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com