


科目:高中化学 来源: 题型:
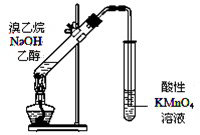
| A、鉴别苯和甲苯:分别加入溴水振荡 |
| B、检验酒精中的少量水:向酒精中加入无水硫酸铜 |
| C、制备纯净的氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D、证明溴乙烷与NaOH醇溶液共热生成乙烯:用如图所示的实验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.25mol |
| B、1.0mol |
| C、0.65mol |
| D、0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石>碳化硅>晶体硅 |
| B、氧化铝>氯化钾>氯化钠 |
| C、H2O>NH3>PH3>AsH3 |
| D、SiC>生铁>纯铁>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com