

| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 液体呈紫红色 | |
| B. | 液体分层,上层为紫色,下层接近无色 | |
| C. | 液体分层,上层接近无色,下层为紫色 | |
| D. | 液体无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 甲烷和乙烷 | ||
| C. | 石墨和C60 | D. | 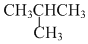 和CH3CH2CH2CH3 和CH3CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥⑦ | B. | ①④⑧ | C. | 只有①④ | D. | 只有⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 等质量的O2和O3中所含的氧原子数相同 | |
| C. | 等物质的量的CO与CO2中所含碳原子数之比为2:7 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
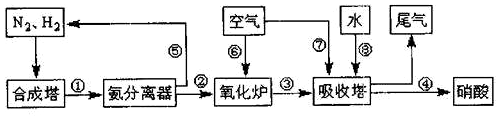

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com