
下列说法正确的是( )
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)
ΔH=-a kJ·mol-1,
Ⅱ: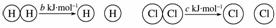
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为(a+b+c)kJ
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:
Cu+基态核外电子排布式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______________________。
(2)已知:
甲醇脱水反应2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应2CH3OH(g)===C2H4(g)+2H2O(g)
ΔH2=-29.1 kJ·mol-1
乙醇异构化反应C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=_________________________________ kJ·mol-1。
与间接水合法相比,气相直接水合法的优点是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列小题。
(1)[2013·江苏,20(1)]白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)[2013·四川理综,11(5)节选]焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)2SO3(g)
ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)
ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是________。
(3)[2013·浙江理综,27(1)]捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq)ΔH3
ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=________。
(4)[2013·天津理综,10(2)①]为减少SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。
已知:H2(g)+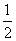 O2(g)===H2O(g)
O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
C(s)+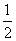 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:______________________________________。
(5)[2013·北京理综,26(2)①]汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
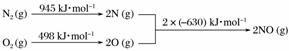
写出该反应的热化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在量热计(如图)中将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1 NaOH溶液混合,温度从298.0 K升高到300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·g-1·K-1(已知CH3COOH电离要吸热)。

(1)CH3COOH的中和热ΔH=____________________________________________。
(2)CH3COOH中和热的文献值为-56.1 kJ·mol-1,你认为造成(1)中测得的实验值有偏差的可能原因是__________________________________________________。
(3)实验中NaOH溶液过量的目的是__________________________。
(4)你认为CH3COOH的中和热与盐酸的中和热绝对值相比,__________的较大,其原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用进行判断,其中正确的是( )
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C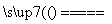 Si+2CO↑
Si+2CO↑
③SiO2+4HF===SiF4↑+2H2O
④Na2CO3+SiO2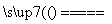 Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤SiO2+3C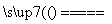 SiC+2CO↑
SiC+2CO↑
a.反应①中SiO2作为玻璃的成分被消耗,用于刻蚀玻璃
b.反应②中SiO2表现出氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④符合用难挥发性的酸酐制取易挥发性酸酐的道理
e.反应⑤中SiO2未参加氧化还原反应
A.ace B.bde C.cde D.ab
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列不发生反应的一组物质是( )
①硅与NaOH溶液 ②硅与盐酸 ③硅与氢氟酸 ④二氧化硅与碳酸钠 ⑤二氧化硅与NaOH溶液 ⑥二氧化硅与浓硝酸
A.①②④ B.③④⑥
C.②⑤⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)海水提溴的过程中不发生氧化还原反应( )
(2)可以用淀粉溶液检验加碘食盐中的KIO3( )
(3)用CCl4萃取碘水中的碘,先振荡,后静置,液体分层,下层呈无色( )
(4)碘易升华,可用加热升华法除去NH4Cl中混有的I2( )
(5)能使湿润的淀粉KI试纸变蓝的气体一定是Cl2( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com