
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
分析 (1)草酸是二元弱酸,其分部电离;
(2)根据溶液中的物料守恒分析;
(3)反应速率与温度、浓度都成正比;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据草酸和高锰酸钾之间的关系式计算草酸的物质的量,再根据质量分数公式计算其纯度;
(5)根据c(Mg2+)•c(C2O42-)与溶度积常数相对大小判断是否完全沉淀,如果c(Mg2+)•c(C2O42-)小于溶度积常数,则完全沉淀.
解答 解:(1)草酸(H2C2O4)是一种二元弱酸,其分部电离,电离方程式为H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,
故答案为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-;
(2)浓度为0.1mol/L的Na2C2O4溶液中存在物料守恒,即:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol/L;
故答案为:0.1;
(3)反应速率与温度、浓度都成正比,二者的温度和浓度都相等,则反应速率相等,则反应速率相等,则褪色时间相等,故答案为:40s;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
设草酸的物质的量为xmol,则:
5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O
5mol 2mol
x 0.0500mol•L-1×0.015L
所以,5mol:2mol=x:0.0500mol•L-1×0.015L
解得x=0.001875mol,
故其纯度=$\frac{0.001875mol×126g/mol}{0.25g}$×100%=94.5%,
故答案为:5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O;94.5%;
(5)1L 0.01mol/LMgCl2溶液中的Mg2+的物质的量是0.01mol,100 mL0.1 mol/L的(NH4)2C2O4溶液的物质的量也是0.01mol,即二者恰好反应.根据溶解平衡MgC2O4(s)?Mg2+(aq)+C2O42-(aq)可知c(Mg2+)•c(C2O42-)=Ksp=8.1×10-5,因为c(Mg2+)=c(C2O42-),所以c(Mg2+)=(8.1×10-5)-1/2=9×10-3 mol/L>10-5 mol/L,故Mg2+未沉淀完全,
故答案为:否.
点评 本题考查了弱电解质的电离、难溶物的溶解平衡、盐类水解等知识点,根据弱电解质的电离特点、溶度积常数、盐类水解特点来分析解答即可,题目难度中等,侧重于考查学生的分析能力和计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
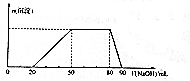 某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )
某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )| A. | 原溶液中一定存在Mg2+、Al3+、H+、SO42- | |
| B. | 原溶液中Al3+的浓度为1mol•L-1 | |
| C. | 原溶液中NH4+的物质的量为0.4mol | |
| D. | 当加入的NaOH的溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 离子化合物中,一定存在金属元素和非金属元素 | |
| C. | 同时含有离子键和共价键的化合物,一定是离子化合物,不可能是共价化合物 | |
| D. | 难失电子的原子,获得电子的能力一定强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
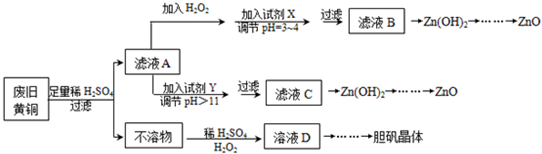
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 二氧化碳、甲烷、氮气都是造成温室效应的气体 | |
| C. | 在工业生产中,研制出在较低温度和压强下能使反应迅速进行的催化剂,可起到很好的节能效果,能体现十八大提出的“绿色发展”理念 | |
| D. | 石油裂解、煤的气化、海水制镁都包含化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
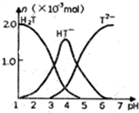 常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )
常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15mL时,溶液中存在:c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20mL时,溶液中存在:c(OH-)=c(HT-)+2c(H2T)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com