
分析 (1)铁与稀盐酸反应生成氯化亚铁和氢气;
(2)氢氧化铜与硫酸反应生成硫酸铜和水;
(3)氯化钡与硝酸银溶液反应生成氯化银沉淀和硝酸钡;
(4)二氧化碳与足量澄清石灰水反应生成碳酸钙沉淀和水;
(5)硫酸与氧化钡反应生成硫酸钡沉淀和水.
解答 解:(1)铁与稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=H2↑+FeCl2,
故答案为:Fe+2HCl=H2↑+FeCl2;
(2)氢氧化铜与硫酸反应生成硫酸铜和水,反应的化学方程式为:Cu(OH)2+H2SO4=2H2O+CuSO4,
故答案为:Cu(OH)2+H2SO4=2H2O+CuSO4;
(3)氯化钡与硝酸银反应的化学方程式为:AgNO3+BaCl2═2AgCl+Ba(NO3)2,
故答案为:AgNO3+BaCl2═2AgCl+Ba(NO3)2;
(4)二氧化碳与澄清石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O,
故答案为:Ca(OH)2+CO2=CaCO3↓+H2O;
(5)硫酸与氧化钡反应的化学方程式为:H2SO4+BaO=BaSO4+H2O,
故答案为:H2SO4+BaO=BaSO4+H2O.
点评 本题考查了化学方程式的书写,题目难度中等,明确发生反应的实质为解答关键,注意掌握化学方程式的书写原则,试题培养了学生的灵活应用能力.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:多选题
| A. | K1=$\frac{[{H}_{2}]^{4}}{[{H}_{2}O]^{4}}$ | |
| B. | 增大c(H2O)或减小c(H2),会使平衡常数K1减小 | |
| C. | 改变反应的温度,平衡常数K1不一定变化 | |
| D. | Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g)的平衡常数为K2,K1×K2=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
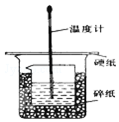 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温州 t1/℃ | 终止温度(t2)/℃[ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b}{a}$ | B. | $\frac{c}{a}$ | C. | $\frac{b-2c}{a}$ | D. | $\frac{b-c}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | 焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 | |
| C. | 钢铁发生电化学腐蚀时,负极的电极反应式为 Fe-3e-=Fe3+ | |
| D. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Cu | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得某HA溶液中c(HA)=0.01mol•L-1 | |
| B. | 碳酸钠溶液中滴入0.1mol•L-1的HA溶液,产生大量无色气体 | |
| C. | 室温下测得某HA溶液的pH=a,用蒸馏水稀释100倍测得溶液pH=b,且b-a<2 | |
| D. | 室温下,测得0.1mol•L-1HA溶液的pH>1,证明HA是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ① | ② | ③ | ④ | ⑤ |
| 物质所含的微粒数 | 固体体积 | 溶液的质量百分比浓度 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com