
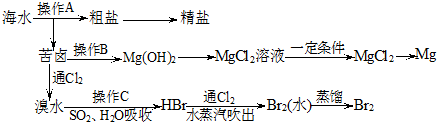
分析 海水晒盐过滤得到苦卤和粗盐,粗盐精制得到饱和食盐水,苦卤中加入石灰乳沉淀镁离子形成氢氧化镁沉淀,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢气流中加热得到氯化镁,电解熔融氯化镁得到金属镁;苦卤中通入氯气氧化溴离子为单质溴,用二氧化硫水溶液吸收溴单质,得到HBr,再通入氯气氧化溴化氢得到溴单质,富集溴元素,用水蒸气吹出蒸馏得到液溴.
(1)对于溶解度受温度影响大的物质可以通过降温结晶的方法得到晶体,对溶解度受温度影响小的物质可以通过蒸发结晶的方法得到晶体;
(2)根据工业制镁的原理从原料的成本以及性质来分析;
(3)氯气氧化溴离子得到单质溴;
(4)电解无水MgCl2可得金属镁和氯气.
解答 解:(1)食盐的溶解度受温度变化影响较小,可以通过蒸发结晶的方法得到氯化钠,
故答案为:蒸发结晶;
(2)工业制镁:把海边的贝壳制成生石灰:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,在海水中加入生石灰:CaO+H2O═Ca(OH)2,在引入的海水中加入石灰乳,发生反应:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,这样原料的成本低,且能将镁离子全部沉淀下来,所以最合适的是石灰乳,
故选:c;
(3)氯气氧化溴离子得到单质溴,离子方程式为:Cl2+2Br-=Br2+2Cl-,溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原生成硫酸和氢溴酸,离子反应方程式为:Br2+SO2+2H2O=4H++SO42-+2Br-,
故答案为:Cl2+2Br-=Br2+2Cl-;Br2+SO2+2H2O=4H++SO42-+2Br-;
(4)电解无水MgCl2可得金属镁和氯气,其反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
点评 本题侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力,属于中等难度的试题.


科目:高中化学 来源: 题型:选择题
| A. | 能与金属铝反应放出氢气的溶液 | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-6的溶液 | |
| C. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合 | |
| D. | 0.01 mol•L-1的氨水与0.01 mol•L-1的HCl溶液等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
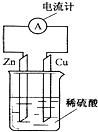
| A. | 锌片逐渐溶解 | B. | 电子由铜片通过导线流向锌片 | ||
| C. | 烧杯中溶液逐渐呈蓝色 | D. | 该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com