
下列物质属于纯净物的是( )
|
| A. | 明矾 | B. | 碱石灰 | C. | 水玻璃 | D. | 漂白粉 |
科目:高中化学 来源: 题型:
某温度下,在固定容积的密闭容器中,反应A(g)+3B(g) 2C
2C (g)达到平衡,测得平衡时A、B、C物质的量之比为1∶1∶2,若保持温度不变,以1∶1∶2的物质的量之比再充入A、B和C,下列判断正确的是( )
(g)达到平衡,测得平衡时A、B、C物质的量之比为1∶1∶2,若保持温度不变,以1∶1∶2的物质的量之比再充入A、B和C,下列判断正确的是( )
A.平衡不移动
B.平衡向逆反应方向移动
C.再次达到平衡时各物质的浓度都比原平衡时大
D.C的质量分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W为短周期元素,原子半径X:99 pm Y:154 pm Z:125 pm W:117 pm,X 、Y、 W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是(双选)( )
| X | ||||
| Y | W |
A.元素Z处于周期表的阴影位置
B.非金属性:X>W
C.X与W形成化合物熔点很高,为离子化合物
D.Y、W的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究温度、硫酸铜对锌与稀硫酸反应速率的影响规律,某同学设计如下方案:
| 编号 | 纯锌粉质量 | 0.2 mol·L-1硫酸体积 | 温度 | 硫酸铜固体质量 |
| Ⅰ | 2.0 g | 10.0 mL | 25℃ | 0 |
| Ⅱ | 2.0 g | 10.0 mL | t℃ | 0 |
| Ⅲ | 2.0 g | 10.0 mL | 35℃ | 0.2 g |
| Ⅳ | 2.0 g | 10.0 mL | 35℃ | 4.0 g |
下列推断合理的是( )
A.为了选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25
B.待测物理量是收集等体积(相同条件)气体所需要的时间,时间越长,反应越快
C.根据该方案,还可以探究硫酸浓度对反应速率的影响
D.根据该实验方案得出反应速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验小组的同学用下列仪器组装两套完全相同的装置,定量探究浓度对反应速率的影响。
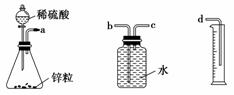
(1)为达到本实验的目的,其装置连接顺序为a连________,________连________。
(2)连接好装置后的下一步操作是__________________________________________________________。
(3)锥形瓶中发生反应的离子方程式为__________________________________________________________。
(4)两套装置的分液漏斗所装的试剂分别为1 mol·L-1硫酸和4 mol·L-1硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1 mol·L-1硫酸 | 10 mL | t1 | v1 |
| 4 mol·L-1硫酸 | 10 mL | t2 | v2 |
该小组同学通过实验得到的结果是:v1小于v2,其定量依据是________。
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol·L-1) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请在给定的坐标图中作出v(H2)-t的图像。
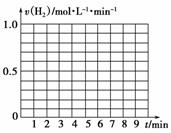
请解释0到4 min时该化学反应速率随时间变化的原因:__________________________________________________________
__________________________________________________________。
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方法有:__________________________________________________________
__________________________________________________________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
|
| A. | 相同温度下,等浓度的Na2CO3和NaHCO3溶液的pH,Na2CO3更大 |
|
| B. | 常温时,Na2CO3的溶解度大于NaHCO3 |
|
| C. | 在酒精灯加热条件下,前者不分解,后者分解 |
|
| D. | 加入澄清石灰水,前者产生沉淀,后者不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某酸性溶液中含有Ba2+、Fe3+,则下列能与上述离子共存的离子组是( )
|
| A. | CO32﹣、SO42﹣、NH4+、Na+ | B. | Cl﹣、SCN﹣、NO3﹣、Cu2+ |
|
| C. | Br﹣、I﹣、Mg2+、Na+ | D. | H+、Cl﹣、NO3﹣、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲研究SO2的性质.
(1)将相关的含硫物质分为如表所示3组,则第2组中物质X的化学式是 H2SO3 .
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)实验室制取SO2的化学方程式为 .
(3)利用下图所示的装置研究SO2的性质:(熔点:SO2﹣76.1℃,SO3 16.8℃,沸点:SO2﹣10℃,SO3 45℃).
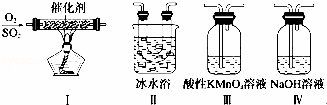
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 .
②甲同学按Ⅰ、Ⅱ、III、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ; 装置Ⅲ中溶液逐渐褪色,生成Mn2+,则该反应的离子方程式是 .
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40mL 2.5mol•L﹣1 NaOH溶液,反应后增重4.8g,则产物(水除外)的物质的量之比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,4个容积均为1 L的容器中,分别进行反应:C(s)+H2O(g)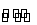 CO(g)+H2(g) ΔH=+131.3 kJ·mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及 正、逆反应速率的关系如
正、逆反应速率的关系如 下表。下列说法正确的是( )
下表。下列说法正确的是( )

A.在容器Ⅱ中,v(正)<v(逆)
B.在容器Ⅳ中,再加入少量C,反应速率加快
C.在容器Ⅲ中, 反应达到平衡时要吸收热量
D.若将平衡时容器Ⅰ、Ⅳ中的物质混合于容积为1 L的容器中,则反应仍处于 平衡状态
平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com